
三、非选择题
9. 硅单质及其化合物的应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:

①写出由纯SiHCl3制备高纯硅的化学方程式: 。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平后的化学方程式: ;H2还原SiHCl3过程中若混有O2,可能引起的后果是 。
(2)下列有关硅材料的说法中正确的是 (填字母)。
A. 碳化硅化学性质稳定,可用于生产耐高温水泥
B. 氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C. 高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D. 普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释: 。
8. (原创)下列叙述中正确的是( )
A. 草木灰和硫铵混合施用可使肥效更高
B. 粗硅的提纯:高温下粗硅与氯气反应后,再通入氢气
C. 工业生产浓硫酸时,用燃烧FeS制得二氧化硫
D. 二氧化硫和氯气均可使有色物质褪色,但漂白原理不同
二、双项选择题
7. (原创)碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如下转化关系:
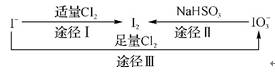
根据上图转化关系推测,下列说法中正确的是( )
A. 可用淀粉 KI试纸和食醋检验加碘盐中是否含有碘
KI试纸和食醋检验加碘盐中是否含有碘
B. 在碘水中通入Cl2,发生反应的化学方程式为5Cl2+I2+6H2O 2HIO3+10HCl
2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>I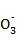
D. 途径Ⅲ中若消耗1 mol Cl2,反应中转移的电子数为nA
6. (2012·湛江三模)化学与科学、技术、社会、环境密切相关。下列说法中不正确的是( )
A. SiC的硬度很大,可用作砂纸、砂轮的磨料
B. 常温下浓硝酸与铝不反应,可用铝质容器存放浓硝酸
C. 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D. Na2O2能与CO2反应产生O2,可用作高空飞行或潜水的供氧剂
5. 下列关于Cl、N、S等非金属元素单质及其化合物的说法中正确的是( )
A. 漂白粉的成分是次氯酸钙
B. 实验室可用浓硫酸干燥硫化氢
C. 将浓氨水滴到氢氧化钠固体中可以制取氨气
D. 单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同
4. 可以验证硫元素的非金属性比氯元素弱的事实是( )
①硫和氢气在加热条件下能形成H2S,H2S受热300 ℃左右分解;氯气和氢气在点燃或光照下生成氯化氢,氯化氢很难分解 ②向氢硫酸溶液中滴入氯水有单质硫生成 ③硫、氯气分别与铜和铁反应,产物是FeS、Cu2S、FeCl3、CuCl2 ④高氯酸(HClO4)的酸性强于硫酸
A. ①②③④ B. ①②
C. ②③④ D. ③④
3. 海水是重要的资源,可以制备一系列物质(见下图)。下列说法中正确的是( )
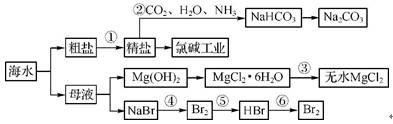
A. 步骤②中,应先通入CO2,再通入NH3
B. 步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C. 步骤④、⑤、⑥反应中,溴元素均被氧化
D. 除去粗盐中的S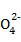 、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
2. (2012·广东六校第二次联考)某课外实验小组设计了下列实验装置,其中合理的是( )
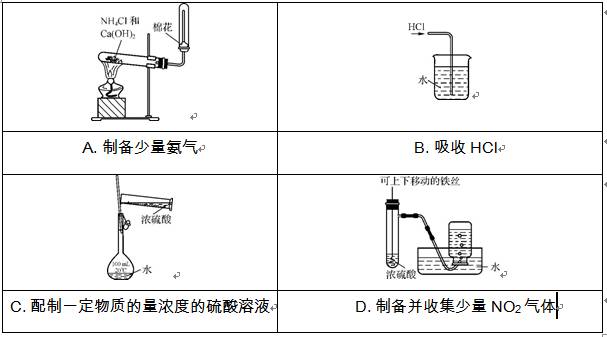
一、单项选择题
1. (原创)下列关于物质的成分和用途的说法中正确的是( )
A. 水晶和光导纤维的主要成分都是硅
B. 常用盐酸来刻蚀玻璃
C. 陶瓷是人类使用较早的硅酸盐材料
D. 实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液
8. (1) B (2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4的溶解度,有利于K2SO4晶体析出
(4) 2S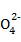 -2e-
-2e- 2S2
2S2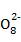
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com