
51. 我国科研人员从天然姜属植物分离出的一种具有显著杀菌、消炎、解毒作用的化合物H。H的合成路线如下:
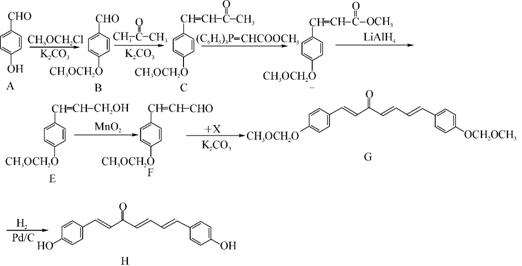
(1) A→B的反应类型是 。
(2) 化合物B中的含氧官能团为 和 (填官能团名称)。
(3) 写出同时满足下列条件的B的一种同分异构体的结构简式: 。
Ⅰ. 苯环上有两个取代基
Ⅱ. 分子中有6种不同化学环境的氢
Ⅲ. 既能与FeCl3溶液发生显色反应,又能发生银镜反应,水解产物之一也能发生银镜反应
(4) 实现F→G的转化中,加入的化合物X(C12H14O3)的结构简式为 。
(5) 化合物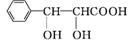 是合成紫杉醇的关键化合物,请写出以
是合成紫杉醇的关键化合物,请写出以 和CH3CHO为原料制备该化合物的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
和CH3CHO为原料制备该化合物的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CH2 CH2
CH2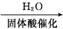 CH3CH2OH
CH3CH2OH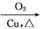 CH3CHO
CH3CHO
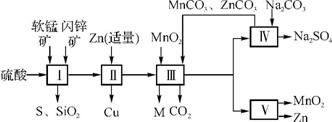
50. 软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Zn(OH)2 |
|
开始沉淀的pH |
4.0 |
2.3 |
5.4 |
|
沉淀完全的pH |
5.2 |
4.1 |
8.0 |
(1) Ⅰ 的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式: 。
(2) Ⅲ中调节溶液的pH至5.25.4,此时生成沉淀M的成分为 、 (填化学式);Ⅲ中加入MnO2的作用是 。
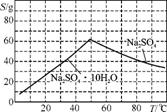
(3) 下图是Na2SO4和Na2SO4·10H2O的溶解度曲线(g/100 g水),则Ⅳ中得到Na2SO4固体的操作是将分离出MnCO3和ZnCO3后的滤液升温结晶、 、用乙醇洗涤后干燥。乙醇洗涤而不用水洗的原因是 。
(4) Ⅴ是用惰性电极电解制得Zn和MnO2,则阳极的电极反应式为 。
(5) 绿色化学思想在本工艺中得到了充分体现,在本工艺流程中可循环使用的物质有MnO2、ZnCO3、MnCO3、 和 (填化学式)。
[有机合成]
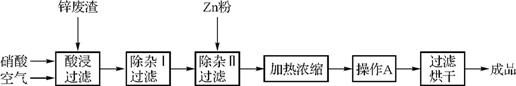
49. 工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
|
氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
|
沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
(1) 在“酸浸”步骤中,为提高锌的浸出速率,通入空气可起到的作用是 。
(2) 在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 。该步应控制溶液的pH范围为 。检验Fe3+在“除杂Ⅰ”步骤中是否沉淀完全的实验操作是 。
(3) 加入Zn粉的作用是 。“操作A”的名称是 。
48. 以粗盐(主要成分为NaCl,含少量Ca2+、Mg2+、Fe3+、S 等)为原料制备亚氯酸钠(NaClO2)的工艺流程如下(试剂A为过量的BaCl2、NaOH、Na2CO3溶液):
等)为原料制备亚氯酸钠(NaClO2)的工艺流程如下(试剂A为过量的BaCl2、NaOH、Na2CO3溶液):
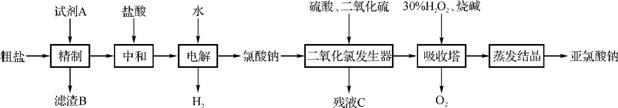
回答下列问题:
(1) “精制”过程中,试剂A中NaOH、Na2CO3、BaCl2溶液的加入顺序是 。滤渣B的主要成分为 (填化学式)。
(2) 电解时发生主要反应的离子方程式为 ;该过程中有少量有毒气体单质产生,可用碱液吸收,该气体为 (填化学式)。
(3) 二氧化氯发生器中发生的化学反应,其氧化剂和还原剂的物质的量之比为 。
(4) 吸收塔中发生反应的化学方程式为 。
47. 用石灰乳、石灰氮(CaCN2)和炼厂气(含H2S)反应,既能净化尾气,又能获得应用广泛的CS(NH2)2(硫脲),其部分工艺流程如下:
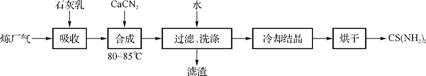
(1) 高温下,H2S存在下列反应:2H2S(g) 2H2(g)+S2(g),其平衡常数表达式为K=
。
2H2(g)+S2(g),其平衡常数表达式为K=
。
(2) 用石灰乳吸收H2S制取Ca(HS)2需要在低温下进行,其原因是 ;过滤得到的滤渣可再利用,滤渣的主要成分是 (填化学式)。
(3) 合成硫脲需长时间搅拌,并在较高温度(8085℃)下进行,其目的是 。Ca(HS)2与CaCN2在水溶液中合成硫脲的化学方程式为 。
(4) 化合物X与硫脲互为同分异构体,X加入FeCl3溶液中,溶液显红色,X的化学式为 。
46. 多晶硅生产工艺流程如下:
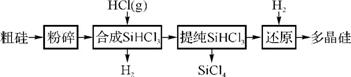
(1) 粗硅粉碎的目的是 。
(2) 合成SiHCl3时发生主要反应的化学方程式为 。
(3) 900℃以上,H2与SiHCl3发生如下反应:SiHCl3
(g)+H2 (g) Si(s)+3HCl
(g) ΔH>0,其平衡常数表达式为K= 。SiHCl3不可接触水分,其与水反应的化学方程式为 。
Si(s)+3HCl
(g) ΔH>0,其平衡常数表达式为K= 。SiHCl3不可接触水分,其与水反应的化学方程式为 。
(4) 该流程中可以循环使用的物质是 。
(5) SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为 。
45. 硝酸锌常用于工业电镀、媒染剂等。用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如下:
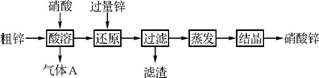
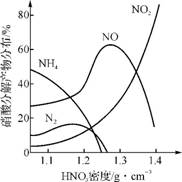
图1
活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同。图1是Fe与不同浓度HNO3溶液反应时的主要还原产物。
(1) 滤渣的成分是 (填化学式)。
(2) Zn2(OH)2CO3与硝酸反应的离子方程式为 。
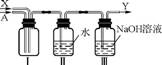
图2
(3) 酸溶过程锌与硝酸反应生成N 的离子方程式为 。
的离子方程式为 。
(4) 利用图2装置对酸溶过程产生的气体A进行回收循环利用。
①气体X为 (填化学式)。
②Ⅱ中发生反应的化学方程式为 。
③装置Ⅲ的作用是 。
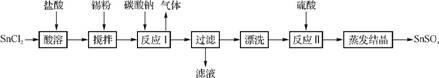
44. 酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是 ,加入Sn粉的作用是 。
(2) 反应Ⅰ生成的沉淀为SnO,写出该反应的化学方程式: 。
(3) 检验沉淀已经“漂洗”干净的方法: 。
(4) 已知:Ksp[Sn(OH)2]=1.0×10-26。反应 Ⅱ 中硫酸的作用之一是控制溶液的pH,若溶液中c(Sn2+)=1.0mol·L-1,则应控制溶液pH 。
(5) 酸性条件下,SnSO4还可以用作双氧水去除剂,试写出发生反应的离子方程式: 。
43. 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
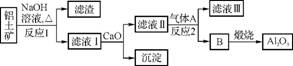
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
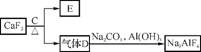
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
回答下列问题:
(1) 写出反应1的化学方程式: 、 。
(2) 滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 。
(3) 化合物C是浓硫酸,E可作为建筑材料。则由D制备冰晶石的化学方程式为 。
(4) 电解法制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
42. 氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
工业ZnO 浸出液
浸出液
 滤液
滤液
 滤液
滤液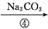
 滤饼
滤饼 ZnO
ZnO
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
回答下列问题:
(1) 反应②中除掉的杂质离子是 ,发生反应的离子方程式为 、 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2) 反应③过滤得到的滤渣中,除了过量的锌外还有 。
(3) 反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4) 反应④中产物的成分可能是ZnCO3·xZn(OH)2。取干燥后的滤饼11.2 g,煅烧后可得到产品8.1 g,则x等于 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com