
5. A
4. A
3. B
2. B
1. B
12. (2013·天津高考改编)FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1) 装置A中发生反应的化学方程式为 。
(2) 第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积的FeCl3进入收集器,第④步操作是 。
(3) 操作步骤中,为防止FeCl3潮解所采取的措施有 (填步骤序号)。
(4) 装置B中冷水的作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
专题五 物质的制备与重要的化工生产
11. (2013·大纲版改编)制备氮化镁的装置示意图如下:
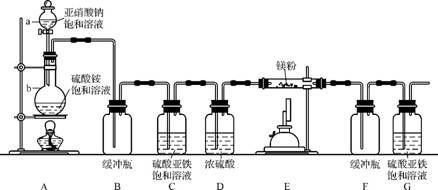
回答下列问题:
(1) a的名称是 ,b的名称是 。
(2) 写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式: 。
(3) C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由: 。
(4) 写出E中发生反应的化学方程式: 。
(5) 请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁。写出实验操作及现象: 。
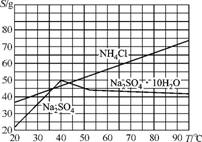
10. 海水晒盐可得卤水,其中主要离子有Na+、Ca2+、Mg2+、Cl-。由卤水制纯碱的工艺改进如下:[NH4HCO3在10-20℃时不易分解,30℃时开始大量分解。NaHCO3的溶解度:S(20 ℃)=9.6 g,S(40 ℃)=12.7 g,S(60 ℃)=16.4 g]

(1) 制取纯碱工艺。
①结合本工艺实际,精制卤水时投料试剂的顺序为 (可供选择的试剂:Na2SO4晶体、纯碱、NH4Cl晶体、石灰乳等)。
②母液Ⅰ中的主要离子有 。
③随着温度升高,NaHCO3的产率下降,原因是 。
(2) 制取Na2SO4·10H2O和NH4Cl晶体。
①加入H2SO4后发生的主要反应的离子方程式为 。
②根据右图所示溶解度曲线分析,工艺中控制70℃以上“趁热过滤”的目的是 。
9. (2013·苏州调研改编)氯气是重要的化工原料。
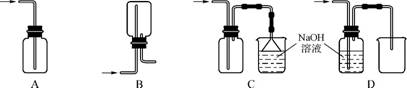
(1) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的装置正确的是 (填字母)。
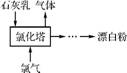
(2) 工业上常用石灰乳和氯气反应制取漂白粉,反应的化学方程式是 。流程如右图所示,其主要设备是氯化塔,塔从上到下分四层。
将含有3%6%水分的石灰乳从塔顶喷洒而入,氯气从塔的最底层通入,这样加料的目的是 。处理从氯化塔中逸出气体的方法是 。
(3) 某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是 ,其原因可能是 ,由此可知(2) 中氯化塔设计为四层是为了减少生产中类似副反应的发生。
(4) 电解饱和食盐水常用隔膜电解槽或离子膜电解槽。下图为阳离子交换膜电解槽(只允许阳离子通过)示意图。

①请判断E为 极。
②制得的烧碱溶液从 (填字母)处流出。
③制得的烧碱溶液中往往含有NaCl,检验其中含有Cl-的具体操作是 。
8. 空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
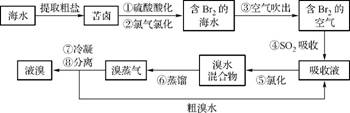
(1) 写出步骤④的离子方程式: 。
(2) 步骤⑥的蒸馏过程中,溴出口温度须控制在80-90℃,温度过高或过低都不利于生产。请解释原因: 。
(3) 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 ,分离时液溴从分离仪器的 (填“上口”或“下口”)排出。
(4) 为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”,请解释原因: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com