
1. (1) N>O>C
(2) 1s22s22p63s23p63d10(或[Ar]3d10)
(3) sp2杂化、sp3杂化 (4) 2NA (5) 氨与水都是极性分子,且氨与水分子间形成氢键 (6) CDE
6. (2013·南京五中模拟)金属铜的导电性仅次于银,大量用于电气工业。
(1) 用金属键理论解释金属铜能导电的原因: 。
(2) 写出铜的基态原子的核外电子排布式: 。
(3) 铜的某种氯化物晶体的晶胞结构如右图所示,该氯化物的化学式为 。 ?
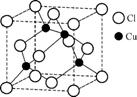
(4) 向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。氨分子中N原子的杂化方式为 。上述深蓝色晶体中含有的化学键除普通共价键外,还有 和 。
专题十一 原子、分子、晶体结构与性质
5. (2013·扬中期中)氮、磷、硫、氯、砷等是农药中的重要组成元素。回答下列问题:
(1) 基态砷的价电子排布式是 。
(2) 下列有关氮、磷、硫、氯的说法不正确的是 (填字母)。
a. 第一电离能由小到大的顺序是S<P<Cl
b. NH3、PH3、AsH3三种物质中沸点最低的是AsH3
c. P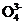 、S
、S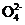 、Cl
、Cl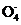 互为等电子体,它们的空间构型均为四面体
互为等电子体,它们的空间构型均为四面体
d. 化合物 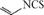 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
(3) 对CoCl3·5NH3的研究表明:①CoCl3·5NH3和硝酸银溶液作用时,其中两个氯离子迅速沉淀,第三个氯离子沉淀缓慢;②溶液导电性测量表明,含1mol CoCl3·5NH3的溶液中含有3mol离子,则配合物中配离子的化学式是 。
(4) 磷化硼是一种受到高度关注的耐磨涂料,其晶胞结构如右图,则磷化硼中磷原子周围距离最近的磷原子的数目是 ,晶体结构中存在的化学键有 (填字母)。
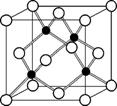
a. 离子键 b. 共价键 c. 分子间作用力 d. 配位键
(5) 肼可用作火箭燃料,燃烧时发生的反应如下:
N2O4(l)+2N2H4(l) 3N2(g)+4H2O(g) ΔH=-1038.7kJ·mol-1
3N2(g)+4H2O(g) ΔH=-1038.7kJ·mol-1
若该反应中有4mol N—H键断裂,则形成的π键有 mol。
4. (2013·扬州中学高考前最后一考)合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一。在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒。除去CO反应的化学方程式如下(HAc表示醋酸):
Cu(NH3)2Ac+CO+NH3 Cu(NH3)3(CO)Ac
Cu(NH3)3(CO)Ac
请回答下列问题:
(1) C、N、O的第一电离能由大到小的顺序为 。
(2) 写出基态Cu+的核外电子排布式: 。
(3) 配合物Cu(NH3)3(CO)Ac中心原子的配位数为 。
(4) 写出与CO互为等电子体的离子: (任写一个)。
(5) 在一定条件下NH3与CO2能合成化肥尿素[CO(NH2)2],尿素中 C原子和N原子轨道的杂化类型分别为 ;1 mol尿素分子中,σ键的数目为 。
3. (2013·南外、海安中学、金陵中学联考)已知A、B、C、D、E、F都是周期表中前四周期元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满。请根据以上信息,回答下列问题:(A、B、C、D、E、F用所对应的元素符号表示)
(1) A、B、C、D的第一电离能由小到大的顺序为 。
(2) 将以下三种物质:①B的氯化物,②D的氯化物,③A、C形成的一种具有高硬度、耐磨新型无机非金属材料,按熔点由高到低的顺序排列: (用序号排列表示)。
(3) A的最高价氧化物对应水化物分子中,其中心原子采取 杂化,E的最高价氧化物分子的空间构型是 。
(4) F的基态原子的核外电子排布式是 , F的高价离子与A的简单氢化物形成的配离子的化学式为 。A的简单氢化物极易溶于水,除了同为极性分子、相似相溶的原因外,另外一个原因是 。
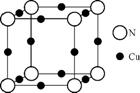
(5) A、F形成某种化合物的晶胞结构如右图所示,则其化学式为 (每个球均表示1个原子)。
2. (2013·南京、盐城一模)氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1) Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②B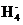 的空间构型是 (用文字描述)。
的空间构型是 (用文字描述)。
(2) 液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是 (填字母)。
2NH3实现储氢和输氢。下列说法正确的是 (填字母)。
a. NH3分子中N原子采用sp3杂化 b. 相同压强时,NH3沸点比PH3高
c. [Cu(NH3)4]2+中,N原子是配位原子 d. CN-的电子式为 C⋮⋮
C⋮⋮ ]-
]-
(3) 2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。
①C60晶体易溶于苯、CS2,说明C60是 (填“极性”或“非极性”)分子。
②1molC60分子中,含有σ键数目为 。

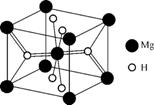
图1 C60分子结构 图2
(4) MgH2是金属氢化物储氢材料,其晶胞结构如图2所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为 cm3[用含a、NA的代数式表示(设NA为阿伏加德罗常数的值)]。
1. (2013·如皋中学段考)CH3COO[Cu(NH3)2]可用于吸收合成氨中对催化剂有毒害的CO气体,加热后CO又可放出,继续循环使用。
(1) C、N、O的第一电离能由大到小的顺序是 。
(2) Cu+的基态电子排布式为 。
(3) CH3COOH分子中C原子的杂化方式为 。
(4) 根据等电子原理判断1mol CO中存在的π键数目为 。
(5) 氨气极易溶于水的原因,除NH3能与水反应外,还有 。
(6) CH3COO[Cu(NH3)2]中存在的化学键有 (填字母)。
A. 金属键 B. 氢键 C. 配位键 D. 非极性键 E. 极性键
18. A
17. C
16. D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com