
3. D
2. D
1. A
12. 寻找新能源是迎接“能源危机”的唯一办法,金属铝在可以预见的将来将会成为一种理想的“新燃料”。
已知:4Al(l)+3C(s) Al4C3(s) ΔH=-374kJ·mol-1
Al4C3(s) ΔH=-374kJ·mol-1
Al4C3(s)+6CO(g) 2Al2O3(s)+9C(s) ΔH=-2 430 kJ·mol-1
2Al2O3(s)+9C(s) ΔH=-2 430 kJ·mol-1
(1) 写出用焦炭还原Al2O3(s)生成Al(l)及CO(g)的热化学反应方程式: 。
(2) 用C高温还原氧化铝,Forster提出通过改变温度分三步获得金属铝,请补充反应③的化学方程式:
①2Al2O3+9C Al4C3+6CO↑;
Al4C3+6CO↑;
②4Al2O3+Al4C3 3Al4O4C;
3Al4O4C;
③ 。

(3) 目前工业上制铝几乎都采用电解氧化铝的方法(原理如右图),2Al2O3(熔融) 4Al(l)+3O2(g),电解槽中阳极为石墨块,石墨除作导电棒外,还具有的作用是 。
4Al(l)+3O2(g),电解槽中阳极为石墨块,石墨除作导电棒外,还具有的作用是 。
(4) 正在开发的铝 空气燃料电池采用中性的盐溶液作电解质溶液,该电池的总反应式为
。
空气燃料电池采用中性的盐溶液作电解质溶液,该电池的总反应式为
。
(5) 铝作为固体火箭燃料,发生的反应为10Al(s)+6NH4ClO4(s) 5Al2O3(s)+3N2(g)+6HCl(g)+9H2O(g) ΔH=-940kJ·mol-1,该反应的氧化产物有 ;135kg铝粉若完全按上述反应燃烧,可产生的热量为 kJ。
5Al2O3(s)+3N2(g)+6HCl(g)+9H2O(g) ΔH=-940kJ·mol-1,该反应的氧化产物有 ;135kg铝粉若完全按上述反应燃烧,可产生的热量为 kJ。
专题十二 化学思想
11. 碘酸盐和高碘酸盐均是强氧化剂,在碱性条件下用过二硫酸钾(K2S2O8)氧化碘酸钾(KIO3)可制取高碘酸钾(KIO4)。其制备步骤为:将KIO3溶解在一定量 30%的KOH溶液中,把溶液加热至沸,在搅拌下加入一定量K2S2O8,继续煮沸510min后冷至室温;除去K2SO4晶体,用硫酸中和至中性,滤出析出的KIO4,再经冰水洗涤、干燥得产品。
(1) 已知:25℃时Ksp[Fe(IO3)3]=1×10-14,Ksp[Fe(OH)3=5×10-38],将Ba(IO3)3溶解在KOH溶液中发生的反应为Fe(IO3)3+3OH- Fe(OH)3+3I
Fe(OH)3+3I ,25℃时该反应的平衡常数为
。
,25℃时该反应的平衡常数为
。
(2) 称取上述样品0.6740g(假定只含KIO3和KIO4两种物质),溶于稍过量的氢碘酸中,使I 、I
、I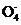 均还原为I2,再移至容量瓶,加水定容配成250.00mL溶液;从中取出25.00mL溶液,用0.1000mol·L-1Na2S2O3溶液进行滴定(2S2
均还原为I2,再移至容量瓶,加水定容配成250.00mL溶液;从中取出25.00mL溶液,用0.1000mol·L-1Na2S2O3溶液进行滴定(2S2 +I2
+I2 2I-+S4
2I-+S4 ),滴定终点时,消耗标准溶液22.00mL。依据本次测定结果通过计算确定样品中KIO4的质量分数(写出计算过程)。
),滴定终点时,消耗标准溶液22.00mL。依据本次测定结果通过计算确定样品中KIO4的质量分数(写出计算过程)。
(3) 在MnSO4酸性溶液中,加入过二硫酸钾溶液,搅拌,可得紫色溶液,该反应的离子方程式为 。
10. 水滑石(LDHs)是一类具有层状结构的功能无机材料,阳离子由Mg2+或离子半径与之接近的二价阳离子和三价阳离子组成。某镁铁水滑石化学式为MgxFey(OH)zCO3·pH2O。为测定该镁铁水滑石的组成,现进行如下实验:
①取2.72g样品于足量稀盐酸中,充分反应后共收集到标准状况下112mL气体。
②取①反应后的溶液,加入足量的NaOH溶液充分反应,得到沉淀,经洗涤、干燥称得质量为2.23g。
③另取2.72g样品,高温下充分加热并灼烧,最后得固体残渣1.60g。
(1) 在t℃时,右图是Fe(OH)3、Mg(OH)2分别在溶液中达到沉淀溶解平衡时c(Fe3+)、c(Mg2+)随pH变化情况,由图可以确定Ksp[Fe(OH)3] (填“>”、“<”或“=”)Ksp[Mg(OH)2];若t℃时Ksp[Fe(OH)3]=1×10-39,欲使c(Fe3+)≤1.0×10-6,溶液的pH≥ 。

(2) 试确定镁铁水滑石的组成(写出计算过程)。
(3) 水滑石结构如下,可作为阻燃剂,加入聚氯乙烯(PVC)中具有明显的阻燃和抑烟效果,其可能的原理是 。

二、非选择题
9. 目前工业上常利用甲烷生产合成气。有关的热化学方程式如下:
CH4(g)+ O2(g)
O2(g) CO(g)+2H2(g) ΔH=-36kJ·mol-1①
CO(g)+2H2(g) ΔH=-36kJ·mol-1①
CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+216kJ·mol-1②
CO(g)+3H2(g) ΔH=+216kJ·mol-1②
(1) 工业上同时利用上述两个反应制合成气,而不单纯采用②的主要理由是 。
(2) 得到的水煤气需要进行变换反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH<0,最后在1000℃下,用过高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高压高温处理的理由是 。
H2(g)+CO2(g) ΔH<0,最后在1000℃下,用过高压水蒸气洗涤混合气体,再经过处理后即可直接作为合成氨的原料气。高压高温处理的理由是 。
(3) 某温度下,在100L反应器中充入甲烷和水蒸气分别为100mol和300mol时,假定只发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),当甲烷的转化率为0.5时,此时平衡常数为
。
CO(g)+3H2(g),当甲烷的转化率为0.5时,此时平衡常数为
。
(4) 用水煤气合成甲醇时,用的催化剂是由CuO和ZnO组成的(质量比为1∶1),由于体系中有二氧化碳,可以使CuO的比例保持相对恒定,从平衡角度考虑,该反应的化学方程式为 。
8. 常温下用两个惰性电极,电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积,假定电解过程中溶液体积不变)。下列说法正确的是( )

A. 0t1时,阳极发生的电极反应为4OH--4e- 2H2O+O2↑
2H2O+O2↑
B. 原溶液中c(Cl-)=c(Cu2+)=0.2mol·L-1
C. t2时,溶液pH=1
D. 电解至t3时,消耗水的质量为0.36g
7. 下图是部分短周期元素化合价与原子序数关系的柱状图,下列说法正确的是( )
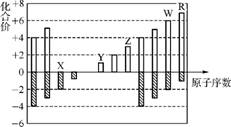
A. 原子半径:X<Y<Z<W<R
B. WX2、WR2分子中各原子均达到8电子结构
C. Y2X2中含有离子键和非极性键
D. 氢化物的稳定性:H2X>H2W>HR
6. 氢氧化物沉淀法是除去废水中金属离子的常用方法。常温下,某浓度金属离子(用通式Men+表示)形成Me(OH)n沉淀与溶液pH关系如下图,已知c(Men+)≤1×10-5 mol·L-1时就认为沉淀完全,Ksp[Fe(OH)3]=1×10-37。下列说法不正确的是( )
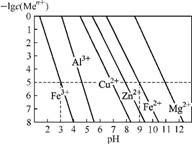
金属离子浓度的负对数与pH的关系
A. pH越高,废水中残留的含金属离子的浓度一定越低
B. 浓度均为1molCu2+和Fe2+的溶液中加入氢氧化钠溶液,当pH=10时,均沉淀完全
C. 图中Fe(OH)3开始沉淀的pH约为1.67
D. c(Men+)、Ksp及pH之间的关系为lg c(Men+)=lg Ksp+14n-npH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com