
1. (2013·北京卷)某学生对SO2与漂粉精的反应进行实验探究:
|
操 作 |
现 象 |
|
取4 g漂粉精固体,加入100
mL水 |
部分固体溶解,溶液略有颜色 |
|
过滤,测漂粉精溶液的pH |
pH试纸先变蓝(约为12),后褪色 |
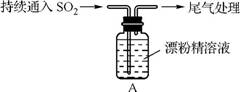 |
i. 液面上方出现白雾 ii. 稍后,出现浑浊,溶液变为黄绿色 iii. 稍后,产生大量白色沉淀,黄绿色褪去 |
(1) Cl2和Ca(OH)2制取漂粉精的化学方程式是 。
(2) pH试纸颜色的变化说明漂粉精溶液具有的性质是 。
(3) 向水中持续通入SO2,未观察到白雾。推测现象i中的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是 。
②由实验a、b不能判断白雾中含有HCl,理由是 。
(4) 现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是 。
(5) 将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀盐酸,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是 。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因: 。
12. (1) Al2O3(s)+3C(s) 2Al(l)+3CO(g)
2Al(l)+3CO(g)
ΔH=+1402kJ·mol-1
(2) Al4O4C+Al4C3 8Al+4CO↑
8Al+4CO↑
(3) 将阳极产生的O2转变为CO、CO2,防止阴极生成的铝被氧化
(4) 4Al+3O2+6H2O 4Al(OH)3↓
4Al(OH)3↓
(5) N2、Al2O3 4.7×105
11. (1) 2×1023
(2) n(I2)=10× n(Na2S2O3)=10×
n(Na2S2O3)=10× ×0.1000mol·L-1×22.00×10-3L=1.1×10-2mol
×0.1000mol·L-1×22.00×10-3L=1.1×10-2mol
依据:I +5I-+6H+
+5I-+6H+ 3I2+3H2O、
3I2+3H2O、
I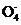 +7I-+8H+
+7I-+8H+ 4I2+4H2O
4I2+4H2O
设KIO3、KIO4的物质的量分别为a、b,则
214 g·mol-1×a+230 g·mol-1×b=0.6740 g
3a+4b=1.1×10-2 mol
解得:a=0.001mol;b=0.002mol
w(KIO4)=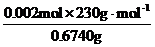 ×100%=68.25%
×100%=68.25%
(3) 5S2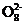 +2Mn2++8H2O
+2Mn2++8H2O 2Mn
2Mn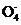 +10S
+10S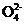 +16H+
+16H+
10. (1) < 3
(2) 由①得:n(C )=n(CO2)=
)=n(CO2)= =0.005mol
=0.005mol
由②得:58x+107y=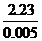 =446
=446
由③得:40x+160× =
=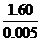 =320
=320
解得x=4,y=2
根据化合价代数和为0有4×2+2×3=2+z,解得z=12
该化合物摩尔质量为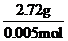 =544g·mol-1,p=
=544g·mol-1,p=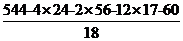 =4
=4
故化学式为Mg4Fe2(OH)12CO3·4H2O
(3) 聚氯乙烯生成的氯化氢的氯离子可与层间的碳酸根进行交换(或LDHs受热分解是吸热反应)
9. (1) 反应②是吸热反应,反应①是放热反应,为反应 ②提供能量
(2) 高温有利于提高反应速率;过高压水蒸气条件下CO转化率增大,且二氧化碳在水中的溶解度也增大
(3) 1.35
(4) CO+2CuO Cu2O+CO2
Cu2O+CO2
(或CO+CuO Cu+CO2)
Cu+CO2)
8. C
7. C
6. A
5. C
4. B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com