
5. (1) 不符合氧化还原反应原理 (2)
①装置气密性良好 ②避免对产物O2的检验产生干扰 移动酒精灯预热硬质玻璃管 (3) ①乙 ②2Na2SO3+O2 2Na2SO4 O2在通过装置B时已参与反应
2Na2SO4 O2在通过装置B时已参与反应
4. (1) 防止倒吸
(2) 2NaClO3+Na2SO3+H2SO4 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
2NaOH+2ClO2+H2O2 2NaClO2+2H2O+O2
2NaClO2+2H2O+O2
(3) 用3860 ℃的温水洗涤
(4) 溶液由蓝色变为无色,且30 s内不变色
(5) 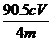 %
%
(6) 4I-+O2+4H+ 2I2+2H2O
2I2+2H2O
3. (1) MgO、CO2 (2) 除CO2 点燃
(3) ①Fe ②Fe3O4+8H+ Fe2++2Fe3++4H2O
Fe2++2Fe3++4H2O
③Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色 假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立(答案合理即可) ④在装置B、C之间添加装置E,以防倒吸(答案合理即可)
(4) 3CO+Fe2O3 3CO2+2Fe
3CO2+2Fe
2. (1) ①溶液呈血红色 ②K3[Fe(CN)6]溶液 ③产生蓝色沉淀 (2) 防倒吸 (3) 用带火星的木条伸入集气瓶中,木条复燃,证明无色气体为氧气 (4) ①b ②Ag、NO2、O2
1. (1) 2Cl2+2Ca(OH)2 CaCl2+Ca(ClO)2+2H2O
CaCl2+Ca(ClO)2+2H2O
(2) 碱性、漂白性
(3) ①检验白雾中是否含有Cl2,排除Cl2干扰 ②白雾中混有SO2,SO2可与酸化的AgNO3反应产生白色沉淀
(4) 向漂粉精溶液中逐滴加入硫酸,观察溶液是否变为黄绿色
(5) ①CaSO4
②SO2+Cl2+2H2O S
S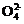 +2Cl-+4H+
+2Cl-+4H+
6. (2013·苏州摸底)过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知:CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1) 用上述方法制取CaO2·8H2O的化学方程式是 。
(2) 沉淀时常用冰水控制温度在0 ℃左右,其可能原因是
① ;
② 。
(3) 测定产品中CaO2含量的实验步骤如下:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1 H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
(已知:I2+2S2
 2I-+S4
2I-+S4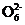 )
)
①CaO2的质量分数为 (用a、c、V的代数式表示)。
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
(4) 已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
|
|
开始沉淀的pH |
沉淀完全的pH |
|
Fe3+ |
1.1 |
3.2 |
|
Fe2+ |
5.8 |
8.8 |
|
Zn2+ |
5.9 |
8.9 |
实验中可选用的试剂:30%H2O2、1.0 mol·L-1 HNO3、1.0 mol·L-1 NaOH。
用过氧化钙处理过的废水中仍含有Fe2+、Fe3+、Zn2+,利用该废水制备ZnO的实验步聚依次为 (填序号)。
①向滤液中加入适量30% H2O2,使其充分反应 ②向滤液中滴加1.0 mol·L-1 NaOH,调节溶液pH约为10(或8.9≤pH≤11),使Zn2+沉淀完全 ③过滤、洗涤、干燥 ④滴加1.0 mol·L-1 NaOH,调节溶液pH约为5(或3.2≤pH<5.9),使Fe3+沉淀完全 ⑤过滤 ⑥900 ℃煅烧
专题十 化学综合实验探究
5. (2013·福建卷)固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出以下4种猜想:
甲:Mg(NO3)2、NO2、O2 乙:MgO、NO2、O2 丙:Mg3N2、O2 丁:MgO、NO2、N2
(1) 实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH NaNO3+NaNO2+H2O。
NaNO3+NaNO2+H2O。
针对甲、乙、丙的猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2) 实验过程
①仪器连接后,放入固体试剂之前,关闭K,微热A,观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3.79 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3) 实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是 。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步研究。
4. (2013·泰州一模)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ. 制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。
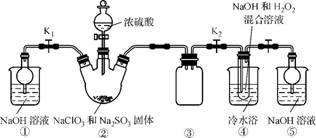
(1) 装置③的作用是 。
(2) 装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
①减压,55 ℃蒸发结晶;②趁热过滤;③ ;④低于60 ℃干燥,得到成品。
实验Ⅱ. 测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:Cl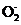 +4I-+4H+
+4I-+4H+ 2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c
mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V
mL(已知:I2+2S2
 2I-+S4
2I-+S4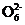 )。
)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
3. (2013·重庆卷改编)某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。
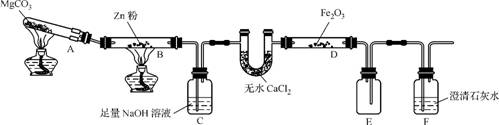
(1) MgCO3的分解产物为 (填化学式)。
(2) 装置C的作用是 ,处理尾气的方法为 。
(3) 将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
|
步骤 |
操 作 |
甲组现象 |
乙组现象 |
|
1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
|
2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
|
3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
|
4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,上图装置还可采取的改进措施是 。
(4) 综上实验,CO还原Fe2O3的高温反应的化学方程式是 。
2. (2013·四川卷改编)为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ. AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。
可选用的试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水。
已知:Fe2+和[Fe(CN)6]3-产生蓝色沉淀。
(1) 请完成下表:
|
操 作 |
现 象 |
结 论 |
|
取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 |
① |
存在Fe3+ |
|
取少量除尽Ag+后的溶液于试管中,加入② ,振荡 |
③ |
存在Fe2+ |
[实验结论] Fe的氧化产物为Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体。在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。

(2) 装置B的作用是 。
(3) 经小组讨论并验证该无色气体为O2,其验证方法是 。
(4) [查阅资料]Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
[提出设想]试管中残留的黑色固体可能是Ⅰ. Ag;Ⅱ. Ag2O;Ⅲ. Ag和Ag2O。
[实验验证]该小组为验证上述设想,分别取少量黑色固体于试管中,进行了如下实验。
|
实验编号 |
操 作 |
现 象 |
|
a |
加入足量氨水,振荡 |
黑色固体不溶解 |
|
b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
[实验评价]根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
[实验结论]根据上述实验结果,该小组得出AgNO3固体热分解的产物有 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com