
9.
(2013·四川高考)在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g) 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
|
t/min |
2 |
4 |
7 |
9 |
|
n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是( )
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
8.
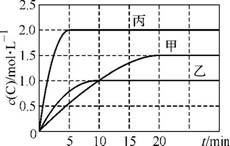
(2013·南京考前复习资料)向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g) 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
|
容 器 |
甲 |
乙 |
丙 |
|
容积 |
0.5L |
0.5L |
1.0L |
|
温度/℃ |
T1 |
T2 |
T2 |
|
反应物 起始量 |
1.5molA 0.5molB |
1.5molA 0.5molB |
6.0molA 2.0molB |
下列说法正确的是( )
A. 10min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. x=1,若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5molA、1.5mol B,平衡时A的转化率为25%
7. 合成氨反应为N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中能量的变化;图2表示在2
L密闭容器中反应时N2的物质的量随时间的变化曲线;图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中能量的变化;图2表示在2
L密闭容器中反应时N2的物质的量随时间的变化曲线;图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对反应平衡的影响。
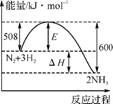
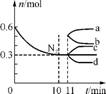
图1 图2
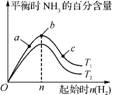
图3
下列说法中正确的是( )
A. 该反应为自发反应,由图1可得加入适当的催化剂,E和ΔH都减小
B. 图2中0-10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器体积为1 L,则n(N2)的变化曲线为d
C. 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D. 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则T1>T2,K1>K2
6. 恒温恒容下,在密闭容器中按不同方式投入反应物,均达到平衡,测得平衡时的有关数据如下[已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1]:
2NH3(g) ΔH=-92.4kJ·mol-1]:
|
容器编号 |
甲 |
乙 |
丙 |
|
反应物投入量 |
1molN2、3molH2 |
2molNH3 |
4molNH3 |
|
平衡时NH3的浓度/mol·
L-1 |
c1 |
c2 |
c3 |
|
反应的能量变化 |
放出Q1kJ |
吸收Q2kJ |
吸收Q3kJ |
|
体系压强/Pa |
p1 |
p2 |
p3 |
|
反应物转化率 |
α1 |
α2 |
α3 |
下列说法中一定正确的是( )
①c1=c2 ②c3=2c2 ③Q1=Q2 ④Q1+Q2=92.4 ⑤p1=p2 ⑥α2>α3
A. ①④⑤⑥ B. ①③⑤⑥
C. ①②③⑥ D. ②③⑤⑥
5. (2013·泰州期末)T1℃时,向容积为2L的密闭容器中充入一定量的A气体和B气体,发生如下反应:
A(g)+2B(g) C(g)
C(g)
反应过程中测定的部分数据见下表:
|
反应时间/min |
n(A)/mol |
n(B)/mol |
|
0 |
1.00 |
1.20 |
|
10 |
0.50 |
|
|
30 |
|
0.20 |
下列说法正确的是( )
A. 前10 min内反应的平均速率为v(C)=0.050 mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.50 mol A气体和0.60 mol B气体,到达平衡时,n(C)<0.25 mol
C. 若密闭容器体积可变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动
D. 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应
4.
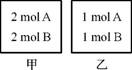
(2013·扬州中学模拟)向甲、乙两个容积均为1L的恒容容器中,分别充入2 molA、2molB和1 molA、1molB。相同条件下,发生下列反应:A(g)+B(g) xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如下图所示:
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如下图所示:
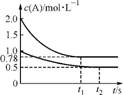
下列说法正确的是( )
A. x可能等于1也可能等于2
B. 向平衡后的乙容器中充入氦气可使c(A)增大
C. 将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
D. 向甲容器中再充入2molA、2molB,平衡时甲容器中0.78mol·L-1<c(A)<1.56mol·L-1
3. (2013·扬泰南连淮三模)用下列实验装置进行相应实验,能达到实验目的的是( )
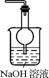

图1 图2
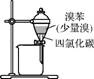

图3 图4
A. 用图1所示装置吸收尾气中的二氧化硫
B. 用图2所示装置配制100 mL 0.100 mol·L-1稀硫酸
C. 用图3所示装置除去溴苯中少量的溴
D. 用图4所示装置制取并收集氨气
2. (2013·南京二模)下列实验装置正确的是( )

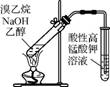
图1 图2

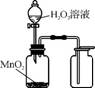
图3 图4
A. 用图1所示装置收集SO2气体
B. 用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C. 用图3所示装置从食盐水中提取NaCl
D. 用图4所示装置制取并收集O2
1. (2013·苏锡常镇徐连六市调研)用下列实验装置进行相应实验,能达到实验目的的是( )
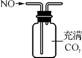
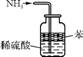
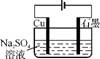

图1 图2 图3 图4
A. 用图1所示装置(正放)可收集NO气体
B. 用图2所示装置可吸收多余氨气且能防止倒吸
C. 用图3所示装置可实现反应:Cu+2H2O Cu(OH)2+H2↑
Cu(OH)2+H2↑
D. 用图4所示装置可分离乙醇(沸点:78.4℃)与二甲醚(沸点:24.9℃)的混合物
6. (1) CaCl2+H2O2+2NH3+8H2O CaO2·8H2O↓+2NH4Cl
CaO2·8H2O↓+2NH4Cl
(2) ①温度低可减少过氧化氢的分解,提高过氧化氢的利用率
②该反应是放热反应,温度低有利于提高CaO2·8H2O的产率
(3) ① %
%
②偏高 在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
(4) ①④⑤②③⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com