
1. (2013·南通二模)在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应。
(1) 若在恒温恒容的容器内进行反应:C(s)+H2O(g) CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 (填字母)。
a. 容器内的压强保持不变 b. 容器中H2的浓度与CO的浓度相等
c. 容器中混合气体的密度保持不变 d. CO的生成速率与H2的生成速率相等
(2) CO 空气燃料电池中使用的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。该电池负极的电极反应式为 。
空气燃料电池中使用的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-。该电池负极的电极反应式为 。
(3) 一定条件下,CO与H2可合成甲烷,反应的化学方程式为CO(g)+3H2(g) CH4(g)+H2O(g)。
CH4(g)+H2O(g)。
①一定条件下,该反应能够自发进行的原因是 。
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJ·mol-1、283.0kJ·mol-1和890.0kJ·mol-1。写出CO与H2反应生成CH4和CO2的热化学方程式: 。
(4) 工业上可通过甲醇羰基化法制取甲酸甲酯,反应的热化学方程式如下:
CH3OH(g)+CO(g) HCOOCH3(g) ΔH=-29.1kJ·mol-1
HCOOCH3(g) ΔH=-29.1kJ·mol-1
科研人员对该反应进行了研究,部分研究结果如下:
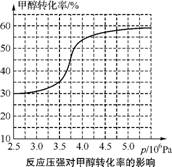
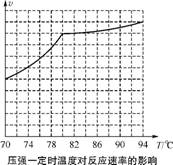
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是 。
②实际工业生产中采用的温度是80℃,其理由是 。
29.取一定质量的Fe、Cu混合物粉末平均分成三份:①第一份加入到100mL某稀硝酸中,充分反应后,剩余金属18.8g,并放出0.10molNO气体;②第二份加入到200mL相同浓度的稀硝酸中,充分 反应后,剩余金属9.6g。求:
(1)此稀硝酸的物质的量浓度为 。
(2)②中产生NO的物质的量为 。
28.实验室通过加热氯化铵和消石灰来制取氨气。
(1)收集氨 应选用下图甲中哪种装置____________________(填序号)。某同学用下图乙来收集,应将氨气从____________________口通入。
应选用下图甲中哪种装置____________________(填序号)。某同学用下图乙来收集,应将氨气从____________________口通入。
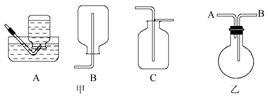
(3)检验集气瓶内是否充满氨一般选用的试剂是___________________。
(4)若要收集到干燥的氨气应将其通过装有 的干燥管。(填序号)
A.浓H2SO4 B.CaCl C.P2O5 D.碱石灰
27.A、B、C、D四种短周期元素,已知:A、D处于同一周期,B、C处于同一周期,A、B处于同一主族,且C单质的焰色反应的颜色为黄色,C和B的原子的质子数之和为27,C和D的原子的质子数之和为17。
试推断:
(1) D元素的最高价氧化物的结构式是__ _____________;
_____________;
(2) A、C两元素的单质加热时形成的化合物的电子式______________。
(3) 用电子式表示B、C两元素形成的化合物的过程______________________。
26.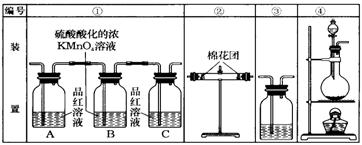 (1)浓硫酸与木炭粉加热反应的化学方程式为:
。
(1)浓硫酸与木炭粉加热反应的化学方程式为:
。
(2)试用上图中所列各装置设计一个实验,验证上述反应所产生的各种产物。这种装置的连接顺序(按产物气流从左到右的方向)是(填图中装置的编
号): → → → 。
(3)实验时B瓶溶液的作用是 。
(4)装置②中所加的固体药品是 。
(5)装置③中所盛的溶液是
 。
。
25.有原子量均大于10的A、B两种元素,它们之间可形成化合物X和Y.已知等物质的量的X和Y的混合物的密度是相同条件下H2密度的18.5倍,其中X与Y的质量比为3∶4.4,经测定X的组成为AB,Y的组成为A2B.试通过计算确定:
A为 ;(填元素符号)B为 (填元素名称)。
23.某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1)Z值为 ;A值 ;
(2)元素X的离子结构示意图为 。
2 4.(10分)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
4.(10分)下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
|
元素代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|
原子半径(nm) |
0.186 |
0.160 |
0.152 |
0.143 |
0.110 |
0.099 |
0.075 |
0.074 |
|
主要化合价 |
+1 |
+2 |
+1 |
+3 |
+5、-3 |
+7、-1 |
+5、-3 |
-2 |
回答下列问题:
(1)⑧在元素周期表中的位置是 。
(2)8种元素的最高价氧化物的水化物中,酸性最强的是 (填化学式)。
(3)④和⑥形成化合物是 (填化学式);其中含有的化学键类型为_ ___ 键 。
(4)下列叙述正确的是 (填序号)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
三、填充题
22.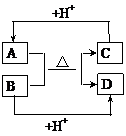 已知:A、B、C、D
已知:A、B、C、D 分别是中学化学中常见的四种不同粒子,它们之间有如下的反应关系:
分别是中学化学中常见的四种不同粒子,它们之间有如下的反应关系:
(1)如果A、B、C、D均是10电子粒子,
请写出A的化学式_______。
(2)如果A和C是18电子的带电粒子,B和D是10电子粒子,
请写出A与B在溶液中反应的离子方程式:  。
。
21.将1.92
g Cu投入一定量的浓HNO3中,铜完全溶解,生成气体的颜色越来越淡,共收集到672 mL 气体(标准状况)。将盛有此气体的容器倒扣在水中,容器内液面上升,再通入 标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入O2的体积是
标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入O2的体积是
A.504 mL B.168 mL C.336 mL D.224 mL
第II卷(非选择题共52分)
20.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A.3 5Cl原子所含质子数为18
5Cl原子所含质子数为18
B.1mol的H35Cl分子所含中子数约为6.02×1023
C.3.5g35Cl2气体的体积约为11.2L
D.35Cl2气体的摩尔质量为70g.mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com