
4. (1) 2a+2b-3c (2) ①< ②9.09%
(3) PbSO4+2e- Pb+S
Pb+S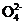
(4) ①Pb2++H2O Pb(OH)++H+ ②Pb2+
Pb(OH)++H+ ②Pb2+
3. (1) 2N2H4(g)+N2O4(g) 3N2(g)+4H2O(g) ΔH=-1083.0kJ·mol-1
3N2(g)+4H2O(g) ΔH=-1083.0kJ·mol-1
(2) ①0.08mol·L-1·min-1 ②<
(3) CO2+2e-+H2O CO+2OH- 否,因为该反应的ΔS<0,ΔG恒大于0
CO+2OH- 否,因为该反应的ΔS<0,ΔG恒大于0
2. (1) B (2) ①二 55 ②> ③-1627.2
(3) CO(NH2)2+H2O-6e- CO2↑+N2↑+6H+
CO2↑+N2↑+6H+
1. (1) ac (2)
CO-2e-+O2- CO2 (3)
①该反应ΔH<0 ②2CO(g)+2H2(g)
CO2 (3)
①该反应ΔH<0 ②2CO(g)+2H2(g) CH4(g)+CO2(g)
CH4(g)+CO2(g)
ΔH=-247.6kJ·mol-1 (4) ①4.0×106 Pa ②高于80℃时,温度对反应速率的影响较小,且反应放热,升高温度使平衡逆向移动,转化率降低
7. (2012·扬泰南苏中三市二模)乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理如下:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
ΔH=-256.1 kJ·mol-1
CH3CH2OH(g)+H2O(g)
ΔH=-256.1 kJ·mol-1
已知:H2O(l) H2O(g) ΔH=+44
kJ·mol-1
H2O(g) ΔH=+44
kJ·mol-1
CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
(1) 以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(l) ΔH= 。
CH3CH2OH(g)+3H2O(l) ΔH= 。
(2) CH4和H2O(g)在催化剂表面发生反应:CH4+H2O CO+3H2,该反应在不同温度下的化学平衡常数如下表。
CO+3H2,该反应在不同温度下的化学平衡常数如下表。
|
温度/℃ |
800 |
1000 |
1200 |
1400 |
|
平衡常数 |
0.45 |
1.92 |
276.5 |
1771.5 |
①该反应是 (填“吸热”或“放热”)反应。
②T℃时,向1 L密闭容器中投入1
mol CH4和1 mol H2O(g),平衡时c(CH4)=0.5 mol·L-1,该温度下反应CH4+H2O CO+3H2的平衡常数K= 。
CO+3H2的平衡常数K= 。

(3) 汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag ZSM
ZSM 5为催化剂,测得NO转化为N2的转化率随温度变化的情况如右图。
5为催化剂,测得NO转化为N2的转化率随温度变化的情况如右图。
若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为 ;在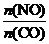 =1的条件下,应控制的最佳温度在 左右。
=1的条件下,应控制的最佳温度在 左右。
(4) 乙醇 空气燃料电池中使用的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池负极的电极反应式为 。
空气燃料电池中使用的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子。该电池负极的电极反应式为 。
专题七 化学反应速率、化学平衡及化学反应与能量的综合应用
6. (2012·南方凤凰台百校大联考)钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用资源。已知:
①3Fe2O3(s)+CO(g) 2Fe3O4(s)+CO2(g) ΔH1=-47
kJ·mol-1
2Fe3O4(s)+CO2(g) ΔH1=-47
kJ·mol-1
②Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH2=-25 kJ·mol-1
2Fe(s)+3CO2(g) ΔH2=-25 kJ·mol-1
③Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
(1) 试计算反应:FeO(s)+CO(g) Fe(s)+CO2(g)的ΔH= 。已知1092℃时该反应的平衡常数为0.357,则1200℃时该反应的平衡常数 (填“>”、“=”或“<”)0.357。在1 L的密闭容器中,投入7.2
g FeO和0.1 mol CO加热到1092℃时并保持该温度,反应达平衡后,气相中CO气体所占的体积分数为 。
Fe(s)+CO2(g)的ΔH= 。已知1092℃时该反应的平衡常数为0.357,则1200℃时该反应的平衡常数 (填“>”、“=”或“<”)0.357。在1 L的密闭容器中,投入7.2
g FeO和0.1 mol CO加热到1092℃时并保持该温度,反应达平衡后,气相中CO气体所占的体积分数为 。
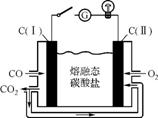
(2) 炼钢尾气净化后,可直接作熔融碳酸盐燃料电池(工作原理如右图)的燃料,则负极的电极反应式为 。
5. (2013·南京、盐城一模)多晶硅是太阳能光伏产业的重要原料。
(1) 由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s) SiO(s)+CO(g) ΔH=a
kJ·mol-1
SiO(s)+CO(g) ΔH=a
kJ·mol-1
2SiO(s) Si(s)+SiO2(s) ΔH=b kJ·mol-1
Si(s)+SiO2(s) ΔH=b kJ·mol-1
则SiO2(s)+2C(s) Si(s)+2CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
Si(s)+2CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
(2) 粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)。不同温度及不同
Si(s)+3HCl(g)。不同温度及不同 时,反应物X的平衡转化率关系如图1。
时,反应物X的平衡转化率关系如图1。
①X是 (填“H2”或“SiHCl3”)。
②上述反应的平衡常数K(1150℃) (填“>”、“<”或“=”)K(950℃)。
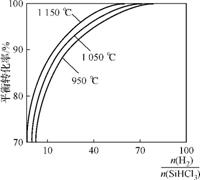

图1 图2
(3) SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。用粗硅作原料,熔盐电解法制取硅烷原理如图2,电解时阳极的电极反应式为 。
4. (2013·盐城二模)铅及其化合物在工业生产及日常生活中都具有非常广泛的用途。
(1) 瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
2PbS(s)+3O2(g) 2PbO(s)+2SO2(g) ΔH=a
kJ·mol-1
2PbO(s)+2SO2(g) ΔH=a
kJ·mol-1
PbS(s)+2PbO(s) 3Pb(s)+SO2(g) ΔH=b kJ·mol-1
3Pb(s)+SO2(g) ΔH=b kJ·mol-1
PbS(s)+PbSO4(s) 2Pb(s)+2SO2(g) ΔH=c kJ·mol-1
2Pb(s)+2SO2(g) ΔH=c kJ·mol-1
则3PbS(s)+6O2(g) 3PbSO4(s) ΔH= kJ·mol-1(用含a、b、c的代数式表示)。
3PbSO4(s) ΔH= kJ·mol-1(用含a、b、c的代数式表示)。
(2) 还原法炼铅,包含反应:PbO(s)+CO(g) Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表。
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表。
|
温度/℃ |
300 |
727 |
1227 |
|
lg K |
6.17 |
2.87 |
1.24 |
①该还原反应的ΔH (填“<”、“>”或“=”)0。
②当lg K=1且起始时只通入CO(PbO足量),达平衡时,混合气体中CO的体积分数为 。
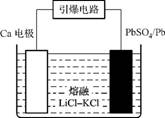
(3) 引爆导弹、核武器的工作电源通常是Ca/PbSO4热电池,其装置如右图所示,该电池正极的电极反应式为 。
(4) 铅易造成环境污染,水溶液中铅的存在形式主要有6种,它们与pH关系如图1所示;含铅废水用活性炭进行处理,铅的去除率与pH关系如图2所示。
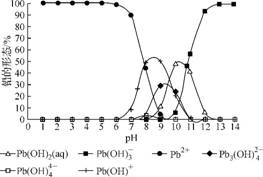

图1 图2
①常温下,pH=67时,铅形态间转化的离子方程式为 。
②用活性炭处理,铅的去除率较高时,铅主要应该处于 (填铅的一种形态的化学式)形态。
3. (2013·徐州质检)火箭升空需要高能燃料,经常是用肼(N2H4)作为燃料,N2O4作氧化剂。
(1) 已知:N2(g)+2O2(g) 2NO2(g) ΔH=+67.7kJ·mol-1
2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
N2(g)+2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g) N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
请写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: 。
(2) 一定条件下,在2L密闭容器中起始时投入2molNH3和4molO2,发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0。测得平衡时的数据如下表。
4NO(g)+6H2O(g) ΔH<0。测得平衡时的数据如下表。
|
有关物质的物质的量/mol |
n(NO) |
n(H2O) |
|
T1 |
1.6 |
2.4 |
|
T2 |
1.2 |
1.8 |
①在T1时,若经过10min反应达到平衡,则10min内反应的平均速率v(NH3)= 。
②T1和T2的大小关系是T1 (填“>”、“<”或“=”)T2。
(3) 在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2 2CO+O2,CO可用作燃料。已知该装置的阳极反应式为4OH--4e-
2CO+O2,CO可用作燃料。已知该装置的阳极反应式为4OH--4e- O2↑+2H2O,则阴极反应式为 。有人提出,可以设计反应:2CO
O2↑+2H2O,则阴极反应式为 。有人提出,可以设计反应:2CO 2C+O2(ΔH>0)来消除CO的污染,请你判断该反应是否能自发进行并说明理由: 。
2C+O2(ΔH>0)来消除CO的污染,请你判断该反应是否能自发进行并说明理由: 。
2. (2013·南师附中等五校联考)尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1) 工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) ΔH=-103.7kJ·mol-1
H2O(l)+H2NCONH2(l) ΔH=-103.7kJ·mol-1
下列措施中有利于提高尿素产率的是 (填字母)。
A. 采用高温 B. 采用高压 C. 寻找更高效的催化剂
(2) 合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(氨基甲酸铵)(l) ΔH1
H2NCOONH4(氨基甲酸铵)(l) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) ΔH2
H2O(l)+H2NCONH2(l) ΔH2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L的密闭容器中投入4 mol氨气和1mol二氧化碳,实验测得反应中各组分随时间的变化如图1所示。
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时达到平衡。
②第二步反应的平衡常数K随温度的变化如图2所示,则ΔH2 (填“>”、“<”或“=”)0。
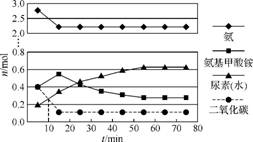
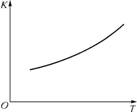
图1 图2
③已知:N2(g)+O2(g) 2NO(g) ΔH=+180.6kJ·mol-1
2NO(g) ΔH=+180.6kJ·mol-1
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
2H2(g)+O2(g) 2H2O(g) ΔH=-483.6kJ·mol-1
2H2O(g) ΔH=-483.6kJ·mol-1
则4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
ΔH= kJ·mol-1。
(3) 尿素燃料电池结构如图3所示。其工作时负极的电极反应式为 。
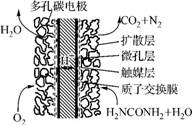
图3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com