
2.A
1.B
12.(17分)(2011·广州二模)下表是元素周期表主族元素的一部分。
|
W |
X |
Y |
|
|
|
Z |
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
(1)Z的元素符号为 ,原子结构示意图为 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为 。
(3)探寻同一主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编 号 |
性质推测 |
化学方程式 |
|
示 例 |
氧化性 |
H2ZO3+4HI Z↓+2I2+3H2O Z↓+2I2+3H2O |
|
1 |
|
|
|
2 |
|
|
专题二 微观结构与物质的多样性
11.(17分)已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出五种元素的元素符号:A 、B 、C 、D 、E 。
(2)用电子式表示离子化合物A2B的形成过程: 。
(3)写出下列物质的电子式:
①D元素形成的单质 ;②E与C形成的化合物 ;
③A、B、E形成的化合物 ;④D与E形成的化合物 。
10.(16分)过氧化氢(H2O2)又叫双氧水,其水溶液可用于制备工业上的漂白粉、特殊环境里燃料燃烧的助燃剂、医疗上的消毒剂、实验室里的制氧剂等。过氧化钠(Na2O2)可用于制备工业上的漂白剂、实验室里的制氧剂、呼吸面具或潜水艇中的制氧剂等。过氧原子团“O2”由2个氧原子共用1对电子形成。
(1)分别写出H2O2、Na2O2的电子式: 。
(2)①H2O、H2O2中化学键的不同点是 。
②Na2O、Na2O2中化学键的不同点是 。
③H2O2的化合物类型是 (填“共价化合物”或“离子化合物”)。
(3)分别写出H2O2、Na2O2作供氧剂时发生反应的化学方程式:
H2O2 。
Na2O2 。
(4)H2O2与Na2O2相比,化学键更稳定的是 (写物质名称),主要依据是 。
三、非选择题
9.(14分)(2012·济南模拟)含化学式为XY2的溶液可作为保湿剂。X原子的结构示意图为 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为 。
(2)Z、W元素的名称为 、 。
(3)下列说法正确的是 。
A.XY2和WZ2都是离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是 。
A.XY2的电子式:X2+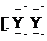 ]2-
]2-
B.WZ2的结构式:Z W
W Z
Z
C.Y元素的单质与H2Z水溶液反应的离子方程式:Y2+Z2- 2Y-+Z↓
2Y-+Z↓
D.用电子式表示XY2的形成过程:
8.Xn+、Ym+、Zp-为三种短周期元素的离子,它们各自带有的电荷数p<n<m=3,且Zp-的电子层数比Xn+、Ym+多1,比较X、Y、Z及其化合物,则下列说法正确的是( )
A.它们的最高价氧化物对应水化物中,Y(OH)m是一种两性氢氧化物,其碱性比X(OH)n弱,其酸性也比Z的最高价含氧酸弱
B.原子半径:Z>X>Y
C.单质的还原性:X>Y
D.Xn+、Ym+、Zp-的半径:Xn+>Ym+>Zp-
二、双项选择题
7.(2012·惠州一中)在元素周期表的主族元素中,甲元素与乙、丙、丁三种元素上下紧密相邻或左右紧密相邻,丙元素的原子序数等于甲、乙两种元素的原子序数之和,四种元素原子的最外层电子数之和为20。下列说法正确的是( )
A.甲、乙、丙、丁四种元素均为短周期元素
B.气态氢化物的稳定性比较:甲>乙
C.最高价氧化物对应水化物的酸性比较:甲<丙
D.丁元素与氢可形成多种氢化物
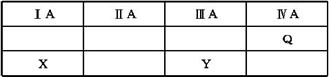
6.(2013·深圳一模)Q、W、X、Y、Z都是短周期元素。X、Y、Q在周期表中的位置关系如右下图。W、Z的最外层电子数相同,Z的核电荷数是W的2倍。则下列说法不正确的是( )
A.非金属性:W>Z
B.原子半径:X>Y>Z
C.最高价氧化物对应水化物的碱性:X>Y
D.氢化物稳定性:Q>W
5.(2012·山西师大附中)下列说法正确的是( )
A.C60气化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温结构陶瓷材料的Si3N4固体是分子晶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com