
5.(1)MnO2+H2O2+H2SO4 MnSO4+O2↑+2H2O
MnSO4+O2↑+2H2O
(2)还原剂
(3)①随pH的升高汞的去除率先降低后增加
②Mn2+具有催化作用
(4)MnO·4ZnO·5Fe2O3
(5)调节滤液离子的成分,使之符合水热后获得锰锌铁氧体组成
4.(1)用带火星的木条靠近干燥管口a,观察木条是否复燃 2SO2+2Na2O2 2Na2SO3+O2↑
2Na2SO3+O2↑
(2)分液漏斗 吸收过量(或多余)的SO2,防止污染空气(或保护环境)
(3)①Na2SO4
②
|
实验操作 |
预期现象和结论 |
|
步骤2:几滴(少量)0.01mol·L-1KMnO4酸性溶液 |
紫红色的KMnO4溶液振荡后褪色 C中含有Na2SO3 |
|
步骤3:过量的1mol·L-1盐酸适量0.1mol·L-1BaCl2溶液 |
无色刺激性气味气体 Na2SO4 |
3.(1)Fe
(2)FeCl2+2H2O Fe(OH)2+2HCl、4Fe(OH)2+O2+2H2O
Fe(OH)2+2HCl、4Fe(OH)2+O2+2H2O 4Fe(OH)3、2Fe(OH)3
4Fe(OH)3、2Fe(OH)3 Fe2O3+3H2O(或4FeCl2+4H2O+O2
Fe2O3+3H2O(或4FeCl2+4H2O+O2 2Fe2O3+8HCl)
2Fe2O3+8HCl)
(3)假设1
|
实验操作 |
预期现象和结论 |
|
步骤1:加入足量的3mol·L-1H2SO4,充分振荡 |
样品全部溶解。 |
|
步骤2:取少许溶液于试管中,加入足量铁粉,充分振荡。 |
试管中出现红色固体,说明试样中有CuO。 |
或:假设2
|
实验操作 |
预期现象和结论 |
|
步骤1:加入足量的3mol·L-1H2SO4,充分振荡 |
样品全部溶解。 |
|
步骤2:取少许溶液于试管中,逐滴加入0.01mol·L-1酸性KMnO4溶液。 |
如果紫红色褪去,说明试样中有FeO。 |
2.(1)5.00mol·L-1 (2)15.68 (3)16.8
1.(1)2.0mol·L-1 (2)NH4Cl
(3)Mg(OH)2·4MgCO3·4H2O
5.(20分)(2012·汕头模拟)铁氧体可用于隐形飞机上吸收雷达波涂料。一种以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:
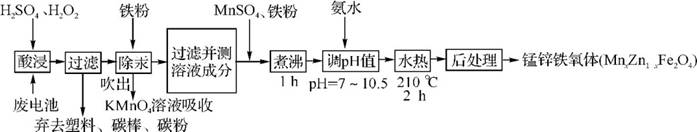
(1)酸浸时,二氧化锰被H2O2还原的化学方程式为 。
(2)活性铁粉除汞时,铁粉的作用是 (填“氧化剂”、“还原剂”或“吸附剂”)。
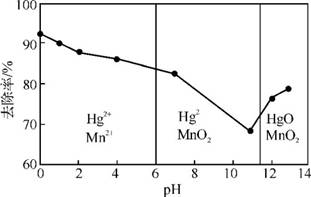
(3)除汞是以氮气为载气吹入滤液带出汞蒸气经KMnO4溶液进行吸收而实现的。右图是KMnO4溶液处于不同pH时对应的Hg去除率变化图,图中物质为Hg与Mn 在该pH范围内的主要产物。
在该pH范围内的主要产物。
①请根据右图给出pH对汞去除率影响的变化规律: 。
②试猜想在强酸性环境下汞的去除率高的原因: 。
(4)当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物形式表示该铁氧体的组成: 。
(5)经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是 。
专题九 综合化学实验与化学计算
4.(20分)(2012·肇庆期末)某同学想通过下图装置实验,探究SO2与Na2O2反应的产物。
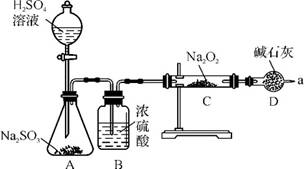
(1)检验反应中是否有O2生成的方法是 ;若有O2生成,请写出装置C中的化学方程式: 。
(2)A中盛装H2SO4溶液的仪器名称是 ;D装置除起了防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应的作用外,还可以 。
(3)①C中固体产物可能只有Na2SO3、只有 、Na2SO3和Na2SO4两种都有。
②若Na2O2反应完全,为确定C中固体产物的成分,该同学设计如下,请你利用限选试剂和仪器帮助他完成该探究过程。
限选试剂和仪器:0.1mol·L-1KMnO4酸性溶液、0.01mol·L-1KMnO4酸性溶液、0.1mol·L-1Ba(NO3)2溶液、0.1mol·L-1BaCl2溶液、1mol·L-1HNO3溶液、1mol·L-1盐酸、试管、胶头滴管。
|
实验操作 |
预期现象和结论 |
|
步骤1:取少量C中固体产物于试管中,加入适量的蒸馏水、搅拌溶解,分别取少量于A、B试管中。 |
固体完全溶解,得到无色透明溶液。 |
|
步骤2:取试管A,向溶液中加入 ,振荡,观察溶液颜色变化。 |
若 , 则 。 |
|
步骤3:取试管B,向其中先加入 ,振荡;再加入 ,振荡。 |
产生 ;? 再加入另一试剂有白色沉淀产生,则固体C中还含有 。 |
3.(20分)(2013·广州一模)大型钢铁企业酸洗钢材时产生的废液主要成分为Fe2+、H+、Cl-,可用下述方法处理该废液,回收盐酸,制备氧化铁涂料。
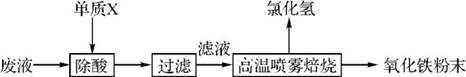
(1)单质X的化学式是 。
(2)氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末。有关反应的化学方程式为 。
(3)某种铁红涂料的成分中,除含有Fe2O3外,还添加有CuO或FeO中的一种。请设计实验探究该铁红涂料中添加的物质。
①提出合理假设
假设1:添加了CuO。 假设2:添加了FeO。
②基于 (填“假设1”或“假设2”),设计实验方案,进行实验。在下表中写出实验操作、预期现象和结论。
限选实验试剂:铁粉、3mol·L-1H2SO4、0.01mol·L-1酸性KMnO4溶液、10%NaOH溶液、10%H2O2、KSCN溶液。
|
实验操作 |
预期现象和结论 |
|
步骤1.取少量样品于试管中, 。 |
|
|
步骤2: |
|
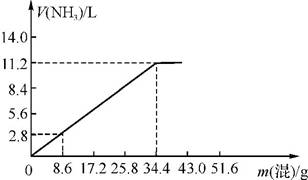
2.(20分)在100mLNaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,右图表示加入的混合物质量与产生的气体体积(标准状况)的关系(假设气体全部逸出)。试计算:
(1)NaOH的物质的量浓度为 。
(2)当NaOH溶液的体积为140mL,固体混合物的质量是51.6g时,充分反应后,生成气体的体积(标准状况)为 L。
(3)当NaOH溶液的体积为180mL,固体混合物的质量仍为51.6g时,充分反应后,生成气体的体积(标准状况)为 L。
1.(20分)以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的Ksp=1.8×10-11,若溶液中c(OH-)=3.0×10-6mol·L-1,则溶液中c(Mg2+)为 。
(2)上述过程中的滤液浓缩结晶,所得主要固体的化学式为 。
(3)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g、标准状况下CO20.896L,通过计算确定碱式碳酸镁的化学式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com