
5.(1)乙 (2)①K=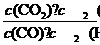 ②50% > = ③降低 增大
②50% > = ③降低 增大
4.(1)b 放热 (2)AC (3)0.15mol·L-1·min-1 12 减小
3.(1)0.054 (2)AD
(3) CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度/ mol·L-1 1.00 1.60 0 0
变化浓度/ mol·L-1 0.20 0.60 0.20 0.20
平衡浓度/ mol·L-1 0.80 1.0 0.20 0.20
K=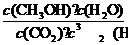 =
=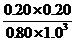 =0.050
=0.050
此反应在300℃时的平衡常数为0.050
(4)< (5)-353.6
2.(1)0.025mol·L-1·min-1 (2)BD
(3)向正反应方向 不变
1.(1)①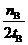 mol·L-1·min-1 ②当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动 ③AD
mol·L-1·min-1 ②当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动 ③AD
④CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9kJ·mol-1
(2)① >
>
②在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失
③
5.(20分)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填序号)。
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0。
|
起始物质的量 |
甲 |
乙 |
丙 |
|
n(H2O)/mol |
0.10 |
0.20 |
0.20 |
|
n(CO)/mol |
0.10 |
0.10 |
0.20 |
①该反应的平衡常数表达式为 。
②平衡时,甲容器中CO的转化率是 。
比较下列容器中CO的转化率:乙 甲;丙 甲(填“>”、“=”或“<”)。
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度 (填“升高”或“降低”),平衡常数K (填“增大”、“减小”或“不变”)。
专题六 化学反应速率和化学平衡
4.(20分)(2012·广州番禺模拟改编)工业上用CO生产燃料甲醇。一定条件下发生反应CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间的变化。
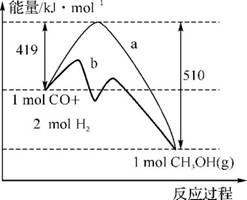
图1
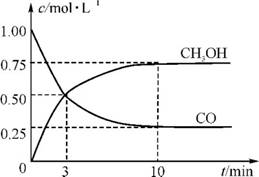
图2
请回答下列问题:
(1)图1中,曲线 (填“a”或“b”)表示使用了催化剂;该反应属于 (填“吸热”或“放热”)反应。
(2)下列说法正确的是 。
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.若CO和H2浓度之比达到1∶2时,反应达到平衡状态
(3)从反应开始到建立平衡,v(H2)= ;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为 。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其他条件不变,将反应体系升温,则该反应的化学平衡常数 (填“增大”、“减小”或“不变”)。
3.(20分)(2012·深圳调研)已知CO2可以生产绿色燃料甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-187.4kJ·mol-1。300℃时,密闭容器中,当c(CO2)=1.00mol·L-1、c(H2)=1.60mol·L-1时开始反应,结果如右图所示。回答
CH3OH(g)+H2O(g) ΔH=-187.4kJ·mol-1。300℃时,密闭容器中,当c(CO2)=1.00mol·L-1、c(H2)=1.60mol·L-1时开始反应,结果如右图所示。回答
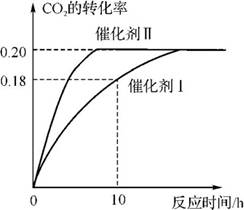
下列问题:
(1)使用催化剂Ⅰ时,反应在10h内的平均反应速率:v(H2)= mol·L-1·h-1。
(2)下列叙述正确的是 。
A.容器内气体的密度不再改变时,反应不一定达到平衡状态
B.充入氩气增大压强有利于提髙CO2的转化率
C.CO2平衡转化率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高
D.催化效率:在上述反应条件下,催化剂Ⅱ比催化剂Ⅰ高
(3)根据图中数据,计算此反应在300℃时的平衡常数(写出计算过程)。
(4)将上述平衡体系升温至400℃,平衡常数:K(400℃) (填“>”、“<”或“=” )K(300℃)。
(5)已知:2H2(g)+O2(g) 2H2O(g) ΔH=-242.8kJ·mol-1,则反应2CH3OH(g)+3O2(g)
2H2O(g) ΔH=-242.8kJ·mol-1,则反应2CH3OH(g)+3O2(g) 2CO2(g)+4H2O(g)
2CO2(g)+4H2O(g)
ΔH kJ·mol-1。
2.(20分)(2012·广州番禺调研改编)在一容积为2L的密闭容器中,加入0.2molN2和0.6molH2,在一定条件下发生反应N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:

(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)= 。
(2)若容器容积不变,下列措施可增加NH3产率的是 。
A.升高温度
B.将NH3(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入0.2molN2和0.6molH2
(3)反应达到平衡后,第5min末,保持其他条件不变,若只把容器的体积缩小一半,平衡 (填“向逆反应方向”、“向正反应方向”或“不”)移动,化学平衡常数 (填“增大”、“减小”或“不变”)。
1.(20分)(2012·广州天河二模)煤的液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,其中合成CH3OH是最重要的研究方向之一。
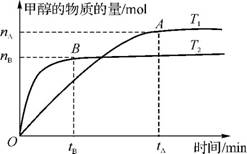
(1)在2L的密闭容器中,由CO2和H2合成甲醇CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如右图所示(注:T2>T1>300℃)。
CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,实验结果如右图所示(注:T2>T1>300℃)。
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 。
②通过分析上图,可以得出温度对反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的影响可以概括为 。
CH3OH(g)+H2O(g)的影响可以概括为 。
③下列情形能说明上述反应已达到平衡状态的是 (填序号)。
A.体系压强保持不变 B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存
C.CH3OH与H2物质的量之比为1∶3 D.每消耗1molCO2的同时生成3molH2
④已知H2(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ·mol-1和-726.5kJ·mol-1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: 。

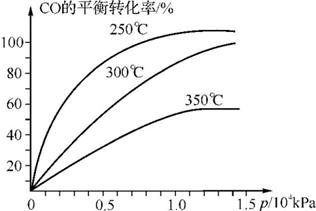
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g) CH3OH(g),CO在不同温度下的转化率与压强的关系如右图所示。
CH3OH(g),CO在不同温度下的转化率与压强的关系如右图所示。
①该反应的平衡常数表达式为K= ,250℃、0.5×104kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104kPa下的平衡常数。
②工业实际生产中,该反应条件控制在250℃、1.3×104kPa左右,选择此压强而不选择更高压强的理由是 。
③在右上图中画出350℃时CO的平衡转化率随压强变化的大致曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com