
10.(16分)(2012·北京高考)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(S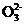 )∶n(HS
)∶n(HS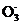 )变化关系如右表。
)变化关系如右表。

①由右表判断NaHSO3溶液显 性,用化学平衡原理解释:
。
②当吸收液呈中性时,溶液中离子浓度关系正确的是 。
A.c(Na+)=2c(S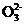 )+c(HS
)+c(HS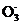 )
)

B.c(Na+)>c(HS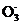 )>c(S
)>c(S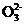 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(S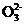 )+c(HS
)+c(HS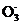 )+c(OH-)
)+c(OH-)
(4)当吸收液的pH降至约为6时,再送至电解槽再生。再生示意图如右图。
①HS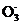 在阳极放电的电极反应式是 。
在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
三、非选择题
9.(14分)(2012·潮州二模改编)
(1)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3 HC
HC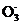 +H+的平衡常数K= (计算结果保留2位有效数字,已知10-5.6=2.5×10-6)。
+H+的平衡常数K= (计算结果保留2位有效数字,已知10-5.6=2.5×10-6)。
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9。下列说法不正确的是 。
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(S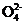 )降低为零
)降低为零
(3)向盛有1mL0.1mol·L-1MgCl2溶液的试管中滴加2滴2mol·L-1NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol·L-1FeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是 (用离子方程式或文字表示)。
8.(2012·珠海二模)下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol·L-1NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(HC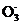 )+c(C
)+c(C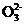 )
)
B.一定量的(NH4)2SO4与NH3·H2O混合所得的酸性溶液中:c(N )<2c(S
)<2c(S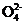 )
)
C.0.2mol·L-1CH3COOH溶液中:c(CH3COOH)+c(CH3COO-)=0.2mol·L-1
D.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,c(N )的大小关系:①>②>③
)的大小关系:①>②>③
二、双项选择题
7.(2012·湛江二模)室温时,0.1mol·L-1HA溶液的pH=3,向该溶液中逐滴加入NaOH溶液,在滴加过程中,有关叙述不正确的是( )
A.未加入NaOH溶液时,原HA溶液中,c(H+)=c(OH-)+c(A-)
B.向原溶液中滴入少量的0.1mol·L-1NaOH溶液,可促进HA的电离,且原溶液的pH降低
C.当滴入的NaOH与HA恰好完全中和时,溶液中c(Na+)=c(A-),且溶液呈中性
D.当加入过量的NaOH溶液时,溶液中离子浓度可能为c(Na+)>c(A-)>c(OH-)>c(H+)
6.(2011·茂名模拟)25℃时,在20mL0.1mol·L-1氢氧化钠溶液中,逐滴加入0.2mol·L-1CH3COOH,溶液pH的变化曲线如右图所示,有关粒子浓度关系的比较不正确的是( )
A.B点时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
C.D点时,c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
5.(2012·广州一模)对于0.1mol·L-1NH4Cl溶液,正确的是( )
A.升高温度,溶液的pH升高 B.通入少量HCl,c(N )和c(Cl-)均增大
)和c(Cl-)均增大
C.c(N )+c(OH-)=c(Cl-)+c(H+) D.c(Cl-)>c(H+)>c(N
)+c(OH-)=c(Cl-)+c(H+) D.c(Cl-)>c(H+)>c(N )>c(OH-)
)>c(OH-)

4.(2012·四川高考)常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液中:c(Na+)>c(HC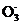 )>c(C
)>c(C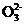 )>c(H2CO3)
)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(N )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
D.0.2mol·L-1CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
3.(2012·天津高考)下列有关电解质溶液的叙述正确的是( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1molKOH的溶液与1molCO2完全反应后,溶液中c(K+)=c(HC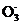 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
2.(2011·广州二模)在一定条件下Na2CO3溶液存在水解平衡C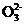 +H2O
+H2O HC
HC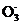 +OH-。下列说法正确的是( )
+OH-。下列说法正确的是( )
A.Na2CO3溶液中:c(Na+)>c(C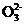 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.升高温度,平衡向逆反应方向移动
C.稀释溶液,溶液中c(H+)和c(OH-)都减小
D.加入NaOH固体,溶液pH减小
一、单项选择题
1.(2012·潮州期末)关于0.1mol·L-1NH4Cl溶液,下列说法正确的是( )
A.升高温度,溶液的pH升高
B.向溶液中加适量氨水使混合液的pH=7,则混合液中c(N )>c(Cl-)
)>c(Cl-)
C.向溶液中加滴加几滴浓盐酸,c(N )减小
)减小
D.向溶液中加入少量CH3COONa固体,c(N )减小
)减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com