
12.(17分)(2012·山东高考)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4的主要流程如下:
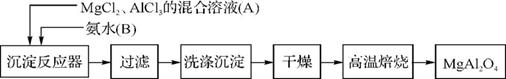
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”或“B”),再滴加另一反应物。
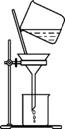
(2)如右图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备:
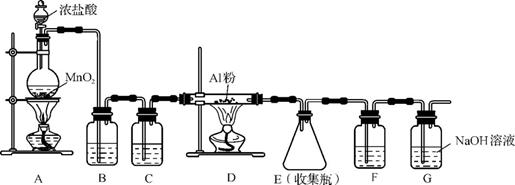
装置B中盛放饱和NaCl溶液,该装置的主要作用是 。F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
专题四 金属元素及其化合物
11.(17分)(2012·广州一模改编)
(1)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%30%的稀硫酸,在5080℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
①写出该实验制备硫酸亚铁的化学方程式: 。
②反应时铁屑过量的目的是 (用离子方程式表示)。
③溶液趁热过滤的原因是 ;塞紧试管口的目的是 。
④静置冷却一段时间后,在试管中观察到的现象是 。
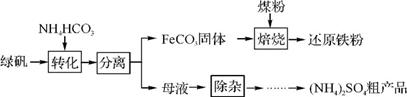
(2)绿矾(FeSO4·7H2O)的一种综合利用工艺如右图所示。
①绿矾与NH4HCO3在溶液中按物质的量之比1∶2反应,有CO2生成,反应的离子方程式为 。
②隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3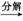 FeO
FeO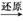 Fe,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式: ; ; 。
Fe,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式: ; ; 。
③母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、 。浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其原因: 。
10.(16分)(2012·海南高考)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为 。
(2)过程Ⅰ加入铁屑的主要作用是 ,分离得到固体的主要成分是 (写化学式),从固体中分离出铜需采用的方法是 。
(3)过程Ⅱ中发生反应的化学方程式为 。
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为 (列式计算)。
三、非选择题
9.(14分)(2012·中山期末)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按右图所示步骤进行。
请根据右图所示流程,回答下列问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 (填仪器名称),操作Ⅱ必须用到的仪器是 (填下列序号)。
A.50mL烧杯 B.20mL量筒 C.50mL量筒 D.25mL滴定管
(2)请写出加入溴水发生反应的离子方程式: 。
(3)检验沉淀是否已经洗涤干净的操作是 。
(4)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 (写出一种原因即可)
8.(2012·江苏高考改编)下列物质转化在给定条件下不能实现的是( )
A.Al2O3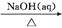 NaAlO2(aq)
NaAlO2(aq)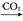 Al(OH)3 B.饱和NaCl(aq)
Al(OH)3 B.饱和NaCl(aq)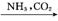 NaHCO3
NaHCO3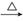 Na2CO3
Na2CO3
C.Fe2O3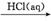 FeCl3(aq)
FeCl3(aq)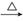 无水FeCl3 D.S
无水FeCl3 D.S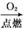 SO3
SO3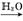 H2SO4
H2SO4
二、双项选择题
7.(2012·中山一模)下列各组反应中最终肯定得到白色沉淀的是( )
A.AlCl3溶液中加入过量氨水 B.Al2(SO4)3溶液中加入过量KOH溶液
C.FeCl2溶液中加入过量氨水 D.MgSO4溶液中加入过量NaOH溶液
6.(2012·安徽高考)已知室温下,Al(OH)3的Ksp远大于Fe(OH)3。向浓度均为0.1mol·L-1的Fe(NO3)3和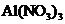 混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
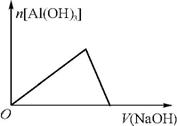
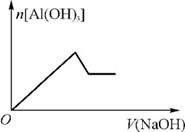
A B
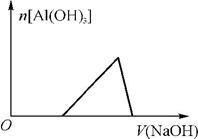
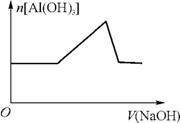
C D
5.(2011·福建高考改编)下表各选项中,不能利用置换反应通过Y得到W的一组化合物是( )
|
选项化合物 |
A |
B |
C |
D |
|
Y |
CO2 |
Cr2O3 |
SiO2 |
Fe2(SO4)3 |
|
W |
MgO |
Al2O3 |
CO |
CuSO4 |
4.(2012·江苏丹阳中学)取ag某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了ag,下列物质不能满足上述结果的是( )
A.H2 B.CH2O C.CH3OH D.C12H22O11
3.(2012·广州调研)某研究小组通过实验探究Cu及其化合物的性质,操作正确且能达到目的的是( )
A.将铜丝插入浓硫酸中加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色
B.常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成
C.将CuCl2溶液在蒸发皿中加热蒸干,得到无水CuCl2固体
D.将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com