
2.D
1.C
12.(17分)(2012·上海高考)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓硝酸或浓硫酸反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓硝酸反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓硝酸反应的化学方程式: 。
(2)已知:Se+2H2SO4(浓) 2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O
2SO2↑+SeO2+2H2O,2SO2+SeO2+2H2O Se+2S
Se+2S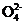 +4H+。
+4H+。
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是 。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
① SeO2+ KI+ HNO3 Se+ I2+ KNO3+ H2O
Se+ I2+ KNO3+ H2O
②I2+2Na2S2O3 Na2S4O6+2NaI
Na2S4O6+2NaI
配平化学方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗0.2000mol·L-1Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为 。
专题一 化学实验基础 化学计量
11.(17分)(2012·湛江一中)某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如右图所示。
(1)SO2气体还原Fe3+生成的还原产物是 (写离子符号),参加反应的SO2和Fe3+的物质的量之比是 。
(2)下列实验方案适用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓硫酸
(3)装置C的作用是 。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥。在这一系列操作中没有用到的仪器有 。
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
①往第一份试液中加入KMnO4溶液,紫红色褪去。
②往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
③往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的一个是 ,原因是 。
(6)上述装置中能表明I-的还原性弱于SO2的现象是 。
10.(16分)(2012·云浮罗定中学)某种溶液仅含右表离子中的5种(不考虑水的电离与离子的水解),且各种离子的物质的量均为1mol。若向原溶液中加入足量的盐酸,有气体生成,并且经分析知:反应前后溶液中阴离子的种类没有变化。
(1)溶液中 (填“一定”、“一定不”或“可能”)含有HC 或C
或C ,理由是 。
,理由是 。
(2)原溶液中所含的阴离子为 ,阳离子为 。
(3)向原溶液中加入足量的盐酸,有无色气体生成的反应的离子方程式为 。

三、非选择题
9.(14分)(2012·广州模拟)
(1)实验室里需用480mL0.1mol·L-1CuSO4溶液。
①以下配制方法正确的是 。
A.称取7.68gCuSO4加入500mL水 B.称取12.0g胆矾加入500mL水
C.称取8.0gCuSO4加入500mL水 D.称取12.5g胆矾配成500mL溶液
②假如其他操作均准确无误,分析下列情况对配制浓度的影响。
A.定容时俯视观察刻度线 。
B.移液时,对用于溶解CuSO4(或胆矾)的烧杯没有洗涤 。
C.定容后,将容量瓶振荡摇匀,静置时发现液面低于刻度线,又补加水至刻度线 。
(2)用98%(密度为1.84g·cm-3)的浓硫酸稀释成3mol·L-1稀硫酸100mL。回答下列问题:
①需要浓硫酸 mL。
②配制操作可分解成如下几步,正确的操作顺序是 。
A.向容量瓶中注入少量水,检查是否漏水
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C.将已冷却的稀硫酸注入已检查不漏水的容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹液面恰好与刻度线相切
H.继续往容量瓶中小心地加水,使液面接近刻度线

8.(2011·韶关一模)下列离子方程式正确的是( )
A.NaHCO3溶液显碱性:HC +H2O
+H2O H3O++C
H3O++C
B.KOH溶液吸收少量SO2:2OH-+SO2 H2O+S
H2O+S
C.Na2O2与H2O反应制备O2:2Na2O2+2H2O 4Na++4OH-+O2↑
4Na++4OH-+O2↑
D.碳酸钠溶液吸收少量醋酸:C +H+
+H+ HC
HC
二、双项选择题
7.(2012·广州模拟)下列说法正确的是( )
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法治炼得到
D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源
6.(2012·广州模拟)在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmolBaCl2,恰好使溶液中的S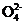 完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中Al3+的浓度(mol·L-1)为( )
完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中Al3+的浓度(mol·L-1)为( )
A.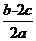 B.
B.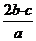 C.
C. D.
D.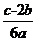
5.(2012·阳江一中、阳春一中联考)下列离子方程式正确的是( )
A.用稀硝酸溶解FeS固体:FeS+2H+ Fe2++H2S↑
Fe2++H2S↑
B.铜与稀硝酸反应:3Cu+2N +8H+
+8H+ 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
C.氨水吸收过量SO2:2OH-+SO2 H2O+S
H2O+S
D.NH4HCO3溶液与过量NaOH溶液反应:N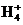 +OH-
+OH- NH3↑+H2O
NH3↑+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com