
10. (2012·广州二模改编)(1)温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,求该温度下CH3COOH的电离平衡常数K。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入 mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
(2)①通常情况下,AgBr呈浅黄色,见光变 色。现向AgBr的悬浊液中,加入更多的AgBr固体,则c(Ag+) (填“变大”、“变小”或“不变”)。
②下列有关难溶盐的溶度积常数及溶解度的叙述,正确的是 (填字母)。
A. 将难溶电解质放入纯水中,溶解达到平衡时,升温Ksp一定增大
B. 两种难溶盐电解质,其中Ksp小的溶解度也一定小
C. 难溶盐电解质的Ksp与温度有关
D. 在一定温度下,向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变

三、非选择题
9.
已知NaHSO4在水中的电离方程式为NaHSO4 Na++H++S
Na++H++S 。运用相关原理,回答下列各小题:
。运用相关原理,回答下列各小题:
(1)常温下,pH=5的NaHSO4溶液中水的电离程度 (填“>”、“=”或“<”)pH=9的NH3·H2O中水的电离程度。
(2)等体积等物质的量浓度的NaHSO4与氨水混合后,溶液呈酸性的原因是 (用离子方程式表示);若一定量的NaHSO4溶液与氨水混合后溶液的pH=7,则c(Na+)+c(N ) (填“>”、“<”或“=”,下同)2c(S
) (填“>”、“<”或“=”,下同)2c(S );用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中S
);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中S 完全沉淀,则反应后溶液的pH 7。
完全沉淀,则反应后溶液的pH 7。
(3)将分别含有Mn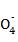 、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH=1,充分反应后:
、Fe3+、Fe2+、I-的四种溶液混合,调节溶液的pH=1,充分反应后:
①若I-有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的有 。
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,一定不存在的有 。
8. (2012·广州天河区一模)下列说法中正确的是( )
A. 0.1 mol·L-1硫酸铵溶液中:c(N )>c(S
)>c(S )>c(H+)
)>c(H+)
B. 常温下,等体积、pH相同的CH3COOH和HCl溶液,消耗NaOH的量一样多
C. 常温下,醋酸钠与醋酸的混合溶液pH=7,则c(Na+)=c(CH3COO-)
D. 0.1 mol·L-1 NaHCO3溶液中:c(Na+)=c(HC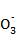 )+2c(C
)+2c(C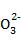 )+c(H2CO3)
)+c(H2CO3)
二、双项选择题
7. (2012·潮州二模)下列溶液中微粒的浓度关系一定正确的是( )
A. 室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(N )
)
B. pH=1的一元酸和pH=13的一元碱等体积混合:c(OH-)=c(H+)
C. 0.1 mol·L-1(NH4)2SO4溶液中:c(N )>c(S
)>c(S )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. 0.1 mol·L-1Na2S溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
6. 下列有关AgCl沉淀的溶解平衡的说法中,错误的是( )
A. AgCl沉淀生成和沉淀溶解不断进行,但速率相等
B. AgCl难溶于水,溶液中没有Ag+和Cl-
C. 升高温度,AgCl沉淀的溶解度增大
D. 向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度降低
5. (2012·湛江一模)常温下,取0.3 mol·L-1 HY溶液与0.3 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)中正确的是( )
A. 混合溶液中由水电离出的c(OH-)=10-9 mol·L-1
B. 溶液中离子浓度由大到小的顺序:c(Y-)>c(Na+)>c(OH-)>c(H+)
C. c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1
D. c(Na+)=c(Y-)+c(HY) =0.3 mol·L-1
4. (2012·广州二摸)下列对于0.1 mol·L-1(NH4)2SO4溶液的说法,正确的是( )
A. 溶液中存在电离平衡:(NH4)2SO4 2N
2N +S
+S
B. 向溶液中滴加少量浓硫酸,c(N
 )与c(S
)与c(S )均增大
)均增大
C. 加水稀释,溶液中所有离子的浓度均减小
D. 溶液中:c(S )=2c(N
)=2c(N )+2c(NH3·H2O)
)+2c(NH3·H2O)
3. (2012·潮州期末)下列关于0.1 mol·L-1 NH4Cl溶液的说法中,正确的是( )
A. 升高温度,溶液的pH升高
B. 向溶液中加适量氨水使混合液的pH=7,则混合液中c(N )>c(Cl-)
)>c(Cl-)
C. 向溶液中滴加几滴浓盐酸,c(N )减小
)减小
D. 向溶液中加入少量CH3COONa固体,c(N )减小
)减小
2. 下列关于pH相同的醋酸和盐酸稀溶液的说法中,错误的是( )
A. 它们都恰好能和等质量的氢氧化钠作用
B. 醋酸的物质的量浓度大于盐酸
C. 两种酸和锌反应刚开始的速度相差不大
D. 同等程度稀释时,醋酸溶液的pH上升较小
一、单项选择题
1. 下列有关pH变化的判断中,正确的是( )
A. 随着温度的升高,碳酸钠溶液的pH减小
B. 随着温度的升高,纯水的pH增大
C. 新制氯水经光照一段时间后,pH减小
D. 氢氧化钠溶液久置于空气中,pH增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com