
8. AC
7. AC
6. B
5. C
4. B
3. D
2. A
1. C
12. (2011·深圳一模)氟和氟盐是化工原料。由于氟气性质活泼,19世纪才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是 ;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上H
 放电产生气体的电极反应式: 。
放电产生气体的电极反应式: 。
(2)利用化学反应也能制取氟。请配平下列化学方程式:
K2MnF6+ SbF5 KSbF6+ MnF3+ F2↑,其中还原产物是 。
KSbF6+ MnF3+ F2↑,其中还原产物是 。
(3)某温度下测得浓度均为0.10 mol·L-1的KF和HF混合溶液的pH=4,近似计算HF的电离平衡常数Ka。(写出计算过程)
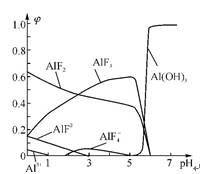
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量φ随pH的分布曲线如右图所示。用NaOH使混合液的pH从5调节到7,写出有关反应的离子方程式: 。
专题八 电解质溶液中的离子平衡
11. (2012·珠海二模改编)Ⅰ. 现用中和滴定法测定某浓度的烧碱溶液。
(1)滴定:用 式滴定管盛装c mol·L-1盐酸标准溶液。右图表示某次滴定时50 mL滴定管中前后液面的位置。将用去的标准盐酸的体积填入下表空格中,此次滴定结束后的读数为 mL,滴定管中剩余液体的体积为 。根据指示剂的变色范围判断,该实验应选用 作指示剂。
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.08.0 |
3.14.4 |
4.46.2 |
8.210.0 |
(2)有关数据记录如下:
|
滴定序号 |
待测液体积/mL |
所消耗盐酸标准液的体积/mL |
||
|
|
|
滴定前 |
滴定后 |
消耗的体积 |
|
1 |
V |
0.50 |
25.80 |
25.30 |
|
2 |
V |
|
|
|
|
3 |
V |
6.00 |
31.35 |
25.35 |
根据所给数据,写出烧碱溶液的物质的量浓度的表达式(不必化简)c= 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”或“偏低”)
①若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 。
②读数时,若滴定前仰视,滴定后俯视,则会使测定结果 。
③若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 。
④滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
Ⅱ. CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6。现将c mol·L-1 CaCl2溶液与2.00×10-2 mol·L-1 Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com