
1. C
12. (2012·广州一模改编)实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量。测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出。
(1)分别写出上述转化反应的离子方程式: 、 。
(2)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表。限选试剂:0.100 0 mol·L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水。
|
实验步骤 |
结果分析 |
|
步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解, |
有白色沉淀生成,说明产品中含有NaCl |
|
步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.100 0 mol·L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1。 ,记录消耗盐酸的体积V2 |
,说明产品中含有NaHCO3 |
专题二 离子反应 氧化还原反应
11. 锌锰废电池可回收锌、锰元素生产硫酸锌及碳酸锰,其中生产工业级碳酸锰工艺如下:
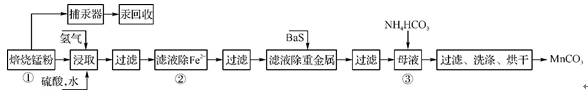
(1)上述过程中的氢气是回收硫酸锌的另一个工艺流程中产生的副产品。已知硫酸锌水溶液显酸性,用离子方程式说明: 。
(2)原料锰粉粗品的主要成分为MnO2和碳,焙烧时反应的化学方程式为MnO2+C MnO+CO↑,该反应的氧化产物是 。
MnO+CO↑,该反应的氧化产物是 。
(3) 5055 ℃时,向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为MnSO4+2NH4HCO3 (NH4)2SO4+MnCO3↓+ + 。
(NH4)2SO4+MnCO3↓+ + 。
(4)已知三种离子沉淀的pH范围为Fe3+:2.73.7、Mn2+:8.610.1、Fe2+:7.69.6 。下表是上述过程②中除去Fe2+的模拟操作方法,请完成下表内容:
|
实验步骤 |
离子方程式 |
|
步骤1:取少量滤液于试管中,加入过量酸化的H2O2溶液,振荡 |
|
|
步骤2:将pH调至 ,使Fe3+沉淀完全 |
Fe3++3H2O Fe(OH)3+3H+ Fe(OH)3+3H+ |
10. (2011·潮州二模改编)高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。干法、湿法制备高铁酸盐的原理如下表所示:
|
干 法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
|
湿 法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
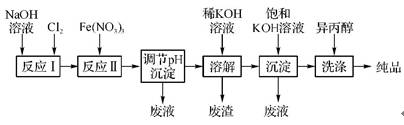
①反应Ⅰ的离子方程式为 。
②反应Ⅱ的化学方程式为 。
(3)高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂。它能消毒杀菌是因为 ,它能净水的原因是 。
三、非选择题
9. (原创)碘酸钾是食盐中的添加剂,工业用粗碘制取KIO3的流程如下:
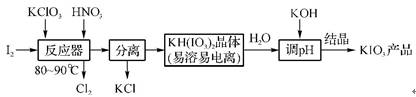
(1)反应器中发生反应的化学方程式为 。
(2)加KOH的离子方程式为 。
(3)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6I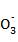 +5CNS-+H++2H2O
+5CNS-+H++2H2O 3I2+5HCN+5S
3I2+5HCN+5S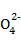 。检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通入SO2的离子方程式为 。
。检验时,除需用KCNS外,还需要的一种试剂最好是 。定量测定产品中KIO3的含量时,可先用水溶解再通入SO2,然后用Na2S2O3标准溶液滴定析出的碘,通入SO2的离子方程式为 。
(4)碘盐在沸水中加热,会缓慢生成两种单质,冷却后的水溶液滴入酚酞变浅红色。试写出碘盐分解的离子方程式: 。
8. 能正确表示下列反应的离子方程式的是( )
A. 硫化钠溶于过量稀硝酸中:S2-+2H+ H2S↑
H2S↑
B. NH4HCO3溶于过量的NaOH溶液中:N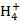 +HC
+HC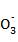 +2OH-
+2OH- C
C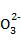 +2H2O+NH3↑
+2H2O+NH3↑
C. 过量CO2通入氢氧化钠溶液中:2OH-+CO2 C
C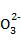 +H2O
+H2O
D. 大理石溶于醋酸中:CaCO3+2CH3COOH Ca2++2CH3COO-+CO2↑+H2O
Ca2++2CH3COO-+CO2↑+H2O
二、双项选择题
7. 下列有关评价合理的是( )
|
选 项 |
化学反应及其离子方程式 |
评 价 |
|
A |
Fe3O4与稀硝酸反应:2Fe3O4+18H+ 6Fe3++H2↑+8H2O 6Fe3++H2↑+8H2O |
正确 |
|
B |
向碳酸镁中加入稀盐酸: C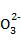 +2H+ +2H+ CO2↑+H2O错误,碳酸镁不应写成离子形式 CO2↑+H2O错误,碳酸镁不应写成离子形式 |
|
|
C |
向硫酸铵溶液中加入氢氧化钡溶液:2N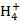 +S +S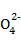 +Ba2++2OH- +Ba2++2OH- BaSO4↓+2NH3·H2O正确 BaSO4↓+2NH3·H2O正确 |
|
|
D |
FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2 2Fe3++4Cl-+Br2 2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为1∶2 |
6. 下列四项分别对应两个反应,其中可用同一个离子方程式表示的是( )
|
选 项 |
(Ⅰ) |
(Ⅱ) |
|
A |
少量SO2通入Ba(OH)2溶液中 |
过量SO2通入少量Ba(OH)2溶液中 |
|
B |
少量NaOH溶液滴入Al2(SO4)3溶液中 |
少量Al2(SO4)3溶液滴入NaOH溶液中 |
|
C |
0.1 mol Cl2通入含0.2 mol FeBr2的溶液中 |
0.3 mol Cl2通入含0.2 mol FeBr2的溶液中 |
|
D |
过量Ba(OH)2溶液与少量Ca(HCO3)2溶液相混合 |
少量Ba(OH)2溶液与过量Ca(HCO3)2溶液相混合 |
5. 在由水电离产生的c(H+)=1×10-13 mol·L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、N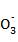 、S2-
、S2-
②K+、Fe2+、I-、S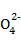
③Na+、Cl-、N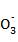 、S
、S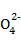
④Na+、Ca2+、Cl-、HC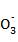
⑤K+、Ba2+、Cl-、N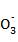
A. ①③ B. ③⑤ C. ③④ D. ②⑤
4.
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉 KI试纸上,试纸变蓝色。下列判断正确的是( )
KI试纸上,试纸变蓝色。下列判断正确的是( )
A. 上述实验证明氧化性:Mn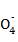 >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B. 上述实验中,共有两个氧化还原反应
C. 实验①生成的气体不能使湿润的淀粉 KI试纸变蓝
KI试纸变蓝
D. 实验②证明Fe2+既有氧化性又有还原性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com