
7.下列选项中物质的名称、俗名、化学式一致的是
A.二氧化碳 冰 CO2 B.氢氧化钙 熟石灰 Ca(OH)2
C.氧化钙 石灰石 CaO D.碳酸钠 烧碱 Na2CO3
6.下图所示的化学实验基本操作中,正确的是


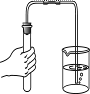
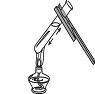
A.倾倒液体 B.称量固体 C.检查气密性 D.加热液体
5.下列物质放入水中,能形成溶液的是
A.牛奶 B.面粉 C.蔗糖 D.花生油
4.下列物质在氧气中燃烧,产生大量白烟的是
A.木炭 B.铁丝 C.酒精 D.红磷
3.下列物质中,属于纯净物的是
A.石灰水 B.空气 C.生铁 D.干冰
2.地壳中含量最多的非金属元素是
A.氧 B.硅 C.铝 D.铁
一、选择题
1.空气成分中,体积分数约占21%的是
A.氧气 B.氮气
C.二氧化碳 D.稀有 气体
气体
33.(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定____________________________________(要求所测得的数据能直接体现反应速率大小)。
② 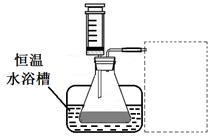 计实验装置,完成图20的装置示意图。
计实验装置,完成图20的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
|
物理量 实验序号 |
V[0.1 mol·L-1Fe2(SO4)3]/mL |
|
…… |
|
1 |
a |
|
…… |
|
2 |
a |
|
…… |
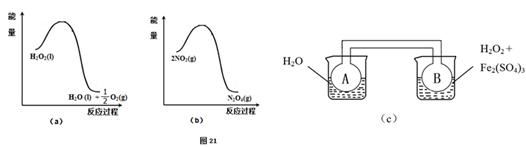
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
32.(16分)石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
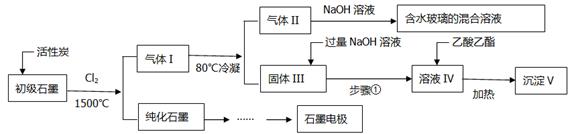
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为________________________,由气体II中某物质得到水玻璃的化学反应方程式为_________________。
 (3)步骤①为:搅拌、________、所得溶液IV中的阴离子有_______________。
(3)步骤①为:搅拌、________、所得溶液IV中的阴离子有_______________。
(4)由溶液IV生成沉淀V的总反应的离子方程式为___________________,100kg初级石墨最多可获得V的质量为___________kg。
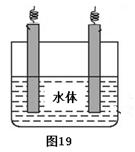
(5)石墨可用于自然水体中铜件的电化学防腐,完成图19防腐示意图,并作相应标注。
31.(16分)
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①  1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1
1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1
② CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g) ∆H2=+210.5kJ∙mol-1
③ CO(g)⇋1/2C(s)+1/2CO2(g) ∆H3=-86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,归纳lgK-T曲线变化规律:
a)_______________________________;b)____________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0X10-5 mol∙L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入____________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为_______________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com