
27、 (8分)
(8分)
(1) 。
 (2) 。
(2) 。
(3)① 。② 。
三、填空题
26、 (9分)
(9分)
(1) , 。
(2) , , 。
(3)
,
 。
。
五、计算
30.工业生产SO3的反应为:2SO2(g)+ O2(g) 2SO3(g)
,若在一定温度下,将0.1mol
2SO3(g)
,若在一定温度下,将0.1mol
的SO2(g)和0.06mol O2(g)注入一体积为2L的密闭容器中,10min达到平衡状态,此时测
得容器中有0.08mol的SO3(g)。试求在该温度下:
(1)SO2(g)的平衡转化率。 (2)此反应的平衡常数。 (要求写出计算过程)
勒流中学2011 ~2012 学年第二学期期末考试
 高二 级化学试题
高二 级化学试题
命题人:张俊
选择题答案填涂在答题卡上
四、实验题
29.(10分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1) 配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制
1000mL溶液。除烧杯和玻璃棒外,还需要用到的主要仪器有__________,__________;
(2) 滴定过程:
①盛装0.10 mol/L的盐酸标准液应该使用_______滴定管;
②滴定时双眼应注意观察___________________________________;
(3) 误差讨论:(选填“偏高”、“偏低”或“无影响” )
① 用蒸馏水冲洗锥形瓶,测定结果__________;
② 在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果__________;
③ 读数时,滴定前仰视,滴定后俯视,测定结果____________;
④ 装标准液之前,没有用标准液润洗滴定管,测定结果____________;
(4) 有关数据记录如下:
|
测定序号 |
待测溶液的体积(mL) |
所耗盐酸标准液的体积(mL) |
|
|
滴定前读数 |
滴定后读数 |
||
|
1 |
20.00 |
0.50 |
20.78 |
|
2 |
20.00 |
1.20 |
21.32 |
计算纯度:烧碱样品的纯度是______________(取两次实验所耗盐酸的平均值进行计算,不写计算过程)
28.(8分)填写下列空格:
(1)草木灰(含K2CO3)显碱性的原因是(用离子方程式表示) ,所以 (填:“能”或“不能”)与铵态氮肥混合施用。
(2)室温下pH=9的NaOH溶液中,由水电离产生的c(OH-)为 mol/L;把0.1mol/LHCl
与0.3mol/L的NaOH溶液等体积混合,所得溶液的pH= 。
(3)3mol/L 100mL H2SO4 溶液与足量的Zn反应,为使产生的H2 速率减慢,但产生的H2
的总量不变,可采取的措施_______________(填下列选项的序号)
A.加醋酸钠固体 B.加NH4Cl溶液 C.加BaCl2溶液 D.加氨水
(4)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)
27.(8分)氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。(1)下图是1 mol NO2(g)和1 mol CO(g)反应生成CO2(g)和NO(g)过程中能量变化示意图,写出NO2和CO反应的热化学方程式 _______ 。
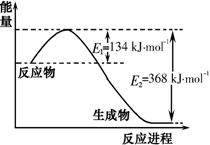
(2)已知:N2(g)+ O2(g)= 2 NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H = -746 kJ • mol-1
则反应CO(g) +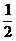 O2(g) = CO2(g)的 △H = kJ • mol-1
O2(g) = CO2(g)的 △H = kJ • mol-1
(3)在固定体积的密闭容器中,1.0×103 kPa时,发生反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 ,其平衡常数K与温度T的关系如下表:
|
T/K |
298 |
398 |
498 |
|
平衡常数K |
51 |
K1 |
K2 |
① K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
三、填空题
26.(9分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,实验室
在配制AgNO3溶液时, 常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的
浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性 ,原因是(用离子方程式表示):
_________________________________; 把AlCl3溶液蒸干,灼烧,最后得到的主要固
体产物是 _______ 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少的 ___________________。
原因是: _______________________________________________ (用离子方程式表示) 。
25. 醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述正确的是
H++CH3COO-,下列叙述正确的是
A.0.10mol/L醋酸溶液中粒子浓度的关系满足:
c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
B.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
C.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液pH=7
24.25℃时,0.1mol·L-1的某一元碱MOH溶液pH = 13,将它和某一元酸HA的溶液等体积混合,混合后的溶液恰好为中性。下列判断正确的是( )
A.HA溶液的pH一定为1 B.盐MA可能水解
C.HA物质的量浓度一定为0.1mol·L-1 D.混合后溶液中,c(M+)一定等于c(A-)
23.在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g)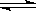 N2O4
(g) △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
N2O4
(g) △H < 0,若把烧瓶置于100℃ 的沸水中,下列情况中不变的是
A.气体的物质的量 B.压强 C.质量 D.密度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com