
3.以下各类盐中,全部可溶于水的是
①硫酸盐 ②镁盐 ③硝酸盐 ④碳酸盐 ⑤钠盐 ⑥钾盐
A. ⑤和⑥ B. ③⑤和⑥ C. 只有③ D. 除去④
2.下列盐的用途中,错误的是
A.用碳酸氢钠治疗胃酸过多 B.用碳酸钙作补钙剂
C.用氯化钠配制生理盐水 D.用含亚硝酸钠的工业用盐烹调食物
一、选择题
|
题目 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
1.下列物质的性质中属于化学性质的是
A. 浓盐酸易挥发 B. 固体氢氧化钠易潮解
C. 浓硫酸有吸水性 D. 硫酸有酸性
25.(原创)(14分)图一是煤化工产业链的一部分,试运用所学知识,回答下列问题:
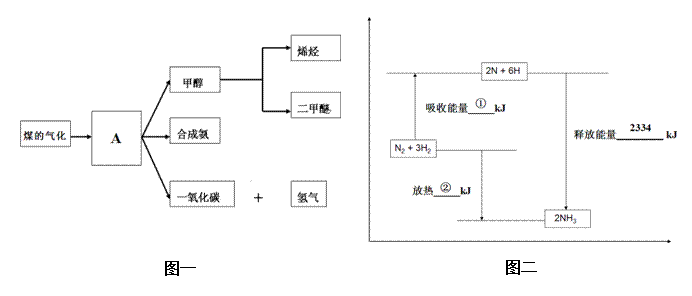
(1)图一中气体A的俗称是_______________
(2)合成氨工业是煤化工产业链中非常重要的一步。已知有一组数据:破坏1mol氮气中的化学键需要吸收946 kJ能量;破坏0.5mol氢气中的H-H键需要吸收218kJ的能量;形成氨分子中1 mol N-H键能够释放389kJ能量。图二表示合成氨工业过程中能量的变化,请将图中①、②的能量变化的数值,填在下边的横线上。
① kJ ,② kJ
(3)煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇,该反应的化学方程式为:CO
(g) + 2H2(g)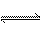 CH3OH(g)
CH3OH(g)
①下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 2v(H2)正 = v(CH3OH)逆
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
②在容积固定的恒温密闭容器中充入CO和H2发生上述反应,反应在第4 min时候达到其限度,此时容器中压强与反应前之比为3︰5,容器内物质的各种物质的量浓度如下表:
|
时间/浓度 |
c(CO)(mol/L) |
c(H2
)(mol/L) |
c(CH3OH)(mol/L) |
|
起始 |
0.200 |
0.300 |
0.000 |
|
第4 min |
a |
b |
c |
则b=__________________
(4)甲醇—空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为2CH3OH (g) + 3O2(g) = 2CO2(g) + 4H2O(l),则负极的电极反应式为______________________,正极附近pH值_______________(填写“增大”、“减小”或者“不变”)

命题人:洪朝刚
审题人:王忠文
2013年重庆一中高2015级高一下学期期末考试
24.(原创)(18分) 工业中很多重要的原料都是来源于石油化工,回答下列问题
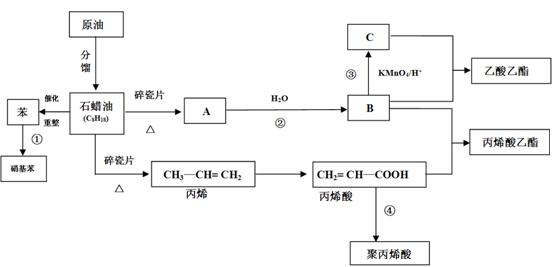
(1)A的结构简式为__________________
(2)丙烯酸中含氧官能团的名称为__________________
(3)写出下列反应的反应类型(填写选项字母):
①________________________________、③_________________________________
A、氧化反应 B、加成反应 C、取代反应 D、加聚反应 E、酯化反应
(4)丙烯酸(CH2 = CH — COOH)的性质可能有:( )
① 加成反应 ②取代反应 ③加聚反应 ④中和反应 ⑤氧化反应
A.只有①③ B.只有①③④
C.只有①③④⑤ D.①②③④⑤
(5)写出下列反应方程式
 ① A
B
________________________________________________
① A
B
________________________________________________
 ② 丙烯酸 +
B 丙烯酸乙酯
________________________________
② 丙烯酸 +
B 丙烯酸乙酯
________________________________
(6)烃A中,当有一个H被一个甲基取代后,最多有_____________个原子共面。
(7)(单选)下列有关该实验的说法中正确的是( )
A. 硝基苯中混有浓HNO3和H2SO4,将其倒入到NaOH溶液中,静置,分液
B. 除去乙酸乙酯中的乙酸,加NaOH溶液、分液
C. 聚丙烯酸能够使酸性高锰酸钾溶液褪色
D. 有机物C与丙烯酸属于同系物
23.(原创)(18分)
Ⅰ.下列有关操作正确的是 _。
①.FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯
②.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验
③.用Cu和Ag作为两极,H2SO4溶液作为电解质溶液,可以构成原电池
④.为了防止自来水管生锈,一般在表面镀上一层Zn
⑤.使用AgNO3溶液验证三氯甲烷中是否含有氯元素,现象是产生白色沉淀
A.②④ B.①② C.③⑤ D.④⑤
Ⅱ. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
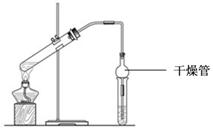
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用
是: 。
(2)已知下表数据:
|
物质 |
熔点/℃ |
沸点/℃ |
密度/(g/cm3) |
|
乙醇 |
-144 |
78 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
|
浓硫酸 |
—— |
338 |
1.84 |
①按装置图安装好仪器后,需要试剂为3 ml 乙醇,2 ml乙酸,适量浓硫酸,请选择合适的加入顺序 。
A. 先加浓硫酸,再加乙醇,最后加乙酸
B. 先加乙醇,再加浓硫酸,最后加乙酸
C. 先加乙酸,再加浓硫酸,最后加乙醇
D. 先加浓硫酸,再加乙酸,最后加乙醇
②根据上表数据分析,为什么乙醇需要过量一些,其原因是 。
(3)按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
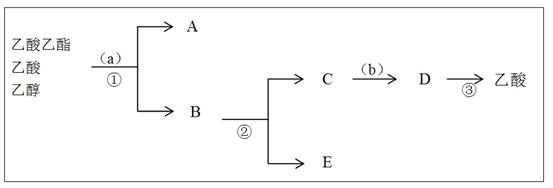
①写出加入的试剂名称: 试剂(a)是 ;试剂(b)是 。
②写出有关的操作分离方法:①是 ,②是 ,③是 。
22.(原创)(16分)下表是元素周期表一部分,列出了十个元素在周期表中的位置:
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
⑥ |
⑦ |
|
|
|
|
3 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
|
4 |
② |
④ |
|
|
|
|
⑨ |
|
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),呈两性的氢氧化物是 (填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有 ;
(4)用电子式表示元素③与⑧形成化合物的过程 。
(5)写出含有32个电子的元素⑥的氢化物的分子式: 。
(6)写出工业冶炼⑤的化学方程式:
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步: ; 第三步Cl2+2Br-=2Cl-+Br2
21.在密闭容器中进行反应X2(g) + 3Y2(g)  2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3
mol/L、0.2 mol/L,达到平衡时下列物质的浓度不可能为
2Z2(g),若X2、Y2、Z2的起始浓度分别为0.1 mol/L、0.3
mol/L、0.2 mol/L,达到平衡时下列物质的浓度不可能为
A. X2为0.3 mol/L B. Y2为0.2 mol/L C. Z2为0.35 mol/L D. Y2为0.6 mol/L
Ⅱ卷(共4题,共66分)
20.(原创) 右图为一重要的烃的衍生物,以下关于它的说法
中不正确的是
A. 1mol该物质,最多可以加成4 mol H2
B. 该物质消耗Na、NaOH、NaHCO3 的物质的量之比为
3 : 2 : 2
C. 可以用酸性高锰酸钾溶液检验其中的碳碳双键
D. 该物质能够在催化剂作用下被氧化为醛
19.在系统命名法中下列碳原子主链名称是丁烷的是
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH3
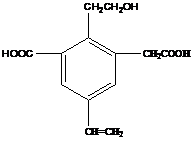
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com