
5. 下列与化学反应能量变化相关的叙述正确的是
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H (g)+Cl
(g)+Cl (g)=2HCl(g)在光照和点燃条件下的△H不同
(g)=2HCl(g)在光照和点燃条件下的△H不同
4. 水是最宝贵的资源之一。下列表述正确的是
A. 4℃时,纯水的pH=7
B. 温度升高,纯水中的c( H
H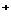 )增大,c(OH
)增大,c(OH )减小
)减小
C. 水的电离程度很小,纯水中主要存在的是水分子
D. 向水中加入酸或碱,都可抑制水的电离,使水的离子积减小
3. 下列反应的能量变化与其他三项不相同的是
A. 铝粉与氧化铁的反应 B. 氯化铵与消石灰的反应
C.  锌片与稀硫酸反应 D. 钠与冷水反应
锌片与稀硫酸反应 D. 钠与冷水反应
2. 在测定中和热的实验中,使用下列用品不是为了减小实验误差的是
A. 碎泡沫塑料 B. 环形玻璃搅拌棒
C. 硬纸板 D. 两个量筒
1. 未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小且可以再生。下列符合未来新能源标准的是
①天然气 ②煤 ③石油 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能
A. ①②③ B. ④⑤⑥⑦
C. ③⑤⑥ D. ③④⑤⑥⑦
五、计算题:
29.(6分)将11.2L(标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应后,溴的四氯化碳溶液的质量增加了8.4g,求原气体混合物中乙烯与乙烷的物质的量之比(没有解题过程不给分)。
四、实验题:
28.(14分)下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙 酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为
。
酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为
。
其中 浓H2SO4的作用是
和
浓H2SO4的作用是
和
 [装置设计]甲、乙、丙三位同学分别设计下列三套实验装置:
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是 (选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是
[实验步骤]
①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4 充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验。
[问题讨论]
⑴步骤①装好实验装置,加入样品前还应检查
 。
。
(2)从试管B中分离出乙酸乙酯的实验操作是 。
三、推断题:
27.(12分)(已知某烃A含碳元素的质量分数为85.7%。结合以下信息回答问题:
(1).若烃A密度是相同状况下氢气密度的42倍。则烃A的相对分子质量_____________,分子式为_____________。
(2). 若烃A可作果实催熟剂。
则由A制取高分子化合物的化学方程式为
A和水在一定条件下反应生成B,B为生活中常见的有机物,B可与另一种生活中常见有机物在一定条件下反应生成有香味的物质C,写出生成C的化学方程式
。
比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示) ,该反应类型是 。
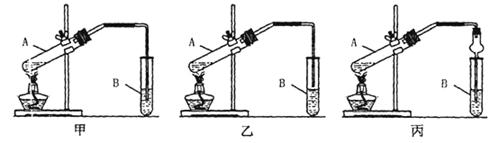
26. (10分)在银锌原电池中,以硫酸铜为电解质溶液,锌为 极,电极上发生的是
反应(“氧化”或“还原”),电极反应式为
(10分)在银锌原电池中,以硫酸铜为电解质溶液,锌为 极,电极上发生的是
反应(“氧化”或“还原”),电极反应式为
,锌片上观察到的现象为
;银电极上的电极反应式是 ,银片上观察到的现象是 。
二、填空题:
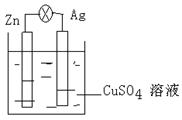
25. (10分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
(10分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。
⑴.阴影部分元素N在元素周期表中的位置为第 周期第
族。根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
⑵.元素S的最高正价和最低负价的代数和为____________,
在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
⑶.Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是________________________________________________。
⑷.下列说法正确的是 。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com