
19.答案 x-n;x+m;x-m;x+n
20答案 
|
实验方案 (只填写选用 试剂序号) |
实验现象 |
结论 |
反应的离子方程式 |
|
|
(1) |
③④⑤ |
|
|
Al3++4OH-===AlO2-+2H2O[或Al3++3OH-===Al(OH)3↓、Al(OH)3+OH-===AlO2-+2H2O] |
|
(2) |
⑥⑧ |
|
|
Cl2+2Br-===Br2+2Cl- |
17. Ca;第四周期ⅡA族
18(1)见图
(2)Na;HClO4;HF (3)C (4)a+25
16. (1)S;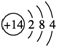 (2)H3PO4(或HPO3)
(3)abc
(2)H3PO4(或HPO3)
(3)abc
(4)①H2DO3+2NaOH===Na2DO3+2H2O(或H2SO3+2NaOH===Na2SO3+2H2O,其他合理答案也可) ②还原性
15. (1)钠(或Na);碳(或C);磷(或P);氯(或Cl)
(2)  (3)两(或2);Na2HPO4、NaH2PO4
(3)两(或2);Na2HPO4、NaH2PO4
21.某同学为探究同周期元素性质的递变规律,设计了一套实验方案,并记录了有关实验现象,请你参与实验并完成实验报告。
(1)实验目的:__________________________。
(2)实验用品:
仪器:试管、胶头滴管、砂纸
药品:镁条、铝条、钠、新制的硫化钠溶液、新制的氯水、0.5 mol·L-1的盐酸、酚酞试液
(3)实验记录(在横线上填入相关内容)
|
实验步骤 |
实验现象 |
|
①将一小块金属钠放入滴有酚酞试液的冷水中 |
钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
②将外形相同的镁条和铝条(均用砂纸打磨过)分别投入足量相同体积的0.5 mol· L-1的盐酸中 L-1的盐酸中 |
镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体 |
|
③将新制的氯水滴加到新制的硫化钠溶液中 |
____________________ |
(4)实验结论:同 一周期元素从左到右,金属性逐渐________(填“减弱”或“增强”,下同),非金属性逐渐__________。
一周期元素从左到右,金属性逐渐________(填“减弱”或“增强”,下同),非金属性逐渐__________。
(5)问题与讨论:
①写出(3)中步骤①反应的离子方程式:_________________________________________。
②试再列举两项事实说明Cl和S的非金属性强弱:________________________________________、______________________________________。
元素周期表和元素周期律(一)答案
20.实验室通过简单的“试管实验”,即可探究元素金属性、非金属性的强弱。请你选用下列试剂,根据实验要求完成下表。
试剂:①镁条 ②铝条 ③AlCl3溶液 ④MgCl2溶液 ⑤NaOH溶液 ⑥氯水 ⑦溴水 ⑧NaBr溶液
|
实验方案 (只填写选用 试剂序号) |
 实验现象 实验现象 |
结论 |
反应的离子方程式 |
|
|
(1) |
_______ |
一支试管中有白色沉淀生成,另一支试管中先生成白色沉淀,后白色沉淀消失 |
金属性: Mg>Al |
Mg2++2OH-===Mg(OH)2↓ _______________________________________________ |
|
(2) |
_______ |
溶液由无色变 为橙黄色 为橙黄色 |
非金 属性: Cl>Br |
________________________ |
19.已知A、B 两元素中A的原子序数为x,A和B所在周期包含元素种类分别为m和n。
两元素中A的原子序数为x,A和B所在周期包含元素种类分别为m和n。
如果A和B同在 ⅠA族,当B在A的上一周期时,B的原子序数为______;当B在A的下一周期时,B的原子序数为______。
如果A和B同在ⅦA族,当B在A的上一周期时,B的原子序数为______;当B在A的下一周期时,B的原子序数为______。
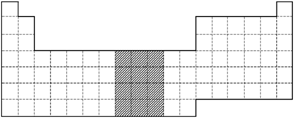
18.下图是中学教材中元素周期表的一部分,试回答下列问题:
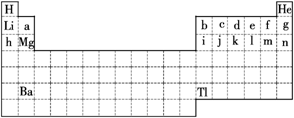
(1)请在图中将第Ⅷ族所在位置涂上阴影。
(2)依据元素周期律,在上图所 列的短周期元素中,原子半径最大的是________(填元素符号),最高价氧化物对应水化物的酸性最强的是__________(填化学式,下同),气态氢化物最稳定的是________。
列的短周期元素中,原子半径最大的是________(填元素符号),最高价氧化物对应水化物的酸性最强的是__________(填化学式,下同),气态氢化物最稳定的是________。
(3)氢元素的常见化合价为+1价,实际上氢元素还可以表现为-1价,从正、负化合价的数值特点分析,第二周期有一种元素与之相似,该元素是________(填元素符号)。
(4)已知Ba的原子序数为a,则Tl的原子序数为__________(用a的代数式表示)。
17.已知某主族元素X的原子核内质子数和中子数之比为 1∶1,在含此金属阳离子的溶液中,此金属阳离子的浓度为 0.8 mol·L-1,10 mL 此溶液恰好能将20 mL 0.4
mol·L-1 Na2CO3溶液中的CO32-全部沉淀,且10
mL 此溶液含此金属阳离子0.32
g。根据计算推断,X是什么元素
1∶1,在含此金属阳离子的溶液中,此金属阳离子的浓度为 0.8 mol·L-1,10 mL 此溶液恰好能将20 mL 0.4
mol·L-1 Na2CO3溶液中的CO32-全部沉淀,且10
mL 此溶液含此金属阳离子0.32
g。根据计算推断,X是什么元素 及其在元素周期表中的位置。
及其在元素周期表中的位置。
16.已知A、B、C、D四种短周期主族元素,其相关信息如下:
①在元素周期表中的相对位置如下:
|
|
A |
|
|
B |
C |
D |
②B元素原子的最外层电子数为其核外电子总数的,D的单质在空气中燃烧时,生成对环境有严重污染的气体。
请回答下列问题:
(1)D的元素符号为________,B的原子结构示意图为_________________ ___。
___。
(2)C的最高价氧化物对应水化物的化学式为________________________。
(3)下列说法中正确的是________(填字母)。
a.A的最高价氧化物对应的水化物在常温下可以和铜反应
b.B的最高价氧化物对应水化物钠盐的水溶液俗称水玻璃
c.常温下,D的最高价氧化物对应水化物的浓溶液可用铁制容器盛放
d.C的离子半径小于D的离子半径
(4)探究法是学习化学的重要方法之一。在下表中列出了对H2DO3各种不同化 学性质的推测,根据示例完成下列表格:
学性质的推测,根据示例完成下列表格:
|
编号 |
性质推测 |
化学方程式 |
|
示例 |
氧化性 |
H2DO3+2H2D===3D↓+3H2O |
|
① |
酸性 |
|
|
② |
|
H2DO3+Br2+H2O===H2DO4+2HBr |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com