
22、(6分)将含有C、H、O的有机物3.24 g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了2.16 g,B管质量增加了9.24 g,已知该有机物的相对分子质量为108。
(1)燃烧此有机物3.24 g需消耗O2多少g?
(2)求此有机物的分子式。
(3)已知该物质中含有苯环,且1mol该物质与金属钠反应后生产标准状况下氢气0.5mol,试写出该物质的任一种结构简式。
21、(10分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为____________ ____。
____。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________ (写化学式)。
(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
(4)已知常温常压下,34g X2M在氧气中完全燃烧,放出热量a kJ,请写出X2M燃烧反应的热化学方程式:______________________________________________________。
(5) ZX的电子式为___________;ZX与水反应放出氢气的化学方程式为___________。
20、(14分)实验是研究化学的基础,试回答以下问题:
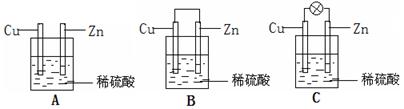
(1)①把一块纯净的锌片插入装有稀硫酸的烧杯里,可观察锌片上有气泡,再平行插入一块铜片(见图A),可观察到铜片 (填“有”或“没有”)气泡产生。再用导线把锌片和铜片连接起来(见图B),组成一个原电池,负极为 ,正极的电极反应式为 ;
②如果烧杯中最初装入的是500mL 2mol/L的稀硫酸溶液,构成铜锌原电池(见图C,假设产生的气体没有损失),当在标准状况下收集到11.2L的氢气时,则此时烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4) = mol/L c(ZnSO4)= mol/L;
(2)下列实验操作中正确的是 ;
A.将含有甲烷、乙烯的混合气体通入酸性KMnO4溶液,可以提纯乙烯
B.向溴水中加入乙醇,充分振荡,可以将溴水中的Br2萃取出来
C.向淀粉溶液中加入少量稀硫酸,加热4~5min,待溶液冷却后加入含氢氧化钠的氢氧化铜悬浊液,加热至沸腾,若未见砖红色沉淀生成,说明淀粉未水解
D.向含有少量乙酸的乙酸乙酯混合液中加入饱和Na2CO3溶液,可以除去乙酸
(3)实验室以动物脂肪为原料可以制取肥皂,请写出硬脂酸甘油酯发生皂化反应的化学方程式 ;
(4)蛋白质在一定条件下可以转化为氨基酸,氨基酸具有两性,其中显酸性的官能团名称是 ,显碱性的官能团名称是 ;
(5)现有A、B、C三种烷烃,它们的分子式都为C5H12
①若A的一氯代物只有一种结构,则A的结构简式是 ;
②若B无支链,则B的结构简式是 ;
③C的习惯命名为 。
19、(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,
发生如下反应:N2 (g) + 3 H2 (g)  2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) =
13mol,nt (NH3) =
6mol,计算a=
。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为
25%。计算平衡时NH3的物质的量n(NH3)=
。
2NH3(g)
(1)若反应进行到某时刻t时,nt (N2) =
13mol,nt (NH3) =
6mol,计算a=
。
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为
25%。计算平衡时NH3的物质的量n(NH3)=
。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,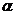 (N2)∶
(N2)∶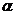 (H2)= 。
(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
18、(18分)石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平。请回答下列问题。
(1)①乙烯的电子式为 。
②下列物质中,可以通过乙烯发生加成反应得到的是 (填序号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2O H D.CH3CH2Br
H D.CH3CH2Br
③工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方
 程式为 ,反应类型是
。
程式为 ,反应类型是
。
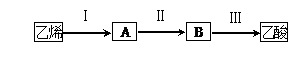 (2)已知
2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
(2)已知
2CH3CHO+O2 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
①反应Ⅱ的化学方程式为 。
②写出A与乙酸反应的化学方程式 。
(3)在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中含有C2H4和SO2。回答下列问题:
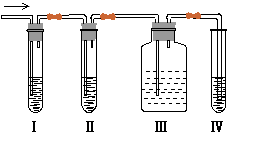
①I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
②能说明SO2气体存在的 现象是
;
现象是
;
③使用装置II的目的是 ;
④使用装置III的目的是 ;
⑤确定含有乙烯的现象是 。
17、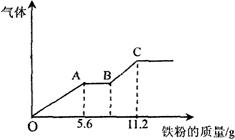 将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份逐渐加入铁粉,产生气体的量随铁粉质量的变化如上图所示。下列判断错误的是
将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g(假设此时硝酸只被还原为NO,下同);向另一份逐渐加入铁粉,产生气体的量随铁粉质量的变化如上图所示。下列判断错误的是
A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点对应消耗NO3-物质的量为0.1 mol
C.B点对应的消耗铁粉的质量为8.4 g
D.原混合酸溶液中H2SO4浓度为2.0 mol·L-1
Ⅱ卷(共60分)
16、短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是
A. 元素X 的简单气态氢化物的热稳定性比W 的强
B. 元素W 的最高价氧化物对应水化物的酸性比Z 的弱
C. 化合物YX、ZX2、WX3 中化学键的类型相同
D. 原子半径的大小顺序: rY >rZ >rW >rX
15、下列关于实验现象的描述,正确的是
A.在盛有苯的试管中加入几滴酸性KMnO4溶液,可观察到紫色褪去
B.用灯光照射盛有CH4与Cl2(体积比1:4)的集气瓶后,可观察到瓶内壁附有油状物
C.向鸡蛋清的溶液中滴加饱和CuSO4溶液,有固体析出,若加入足量蒸馏水,固体可以重新溶解
D.将红热的铜丝迅速插入乙醇中,反复多次,可观察到铜丝表面变黑,并能闻到香味
14、在一定温度下, A2、B2、AB三种分子有如下反应发生:A2(g)
+ B2(g)  2AB(g),
2AB(g),
该反应达到平衡时的标志是
A.容器内压强不随时间变化
B.AB的生成速率与消耗速率相等
C.A2、B2、AB的浓度不再变化
D.A2、B2、AB的分子数之比为1:1:2
13、为探究锌与稀硫酸反应生成H2的速率(以v(H2)表示),可以向反应混合液中加入某些物质,下列判断正确的是
A.将稀硫酸换作浓硫酸,v(H2)增大
B.滴加少量CuSO4溶液,v(H2) 增大
C.用锌粉代替锌粒,v(H2) 不变
D.加入少量水,v(H2)减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com