
7.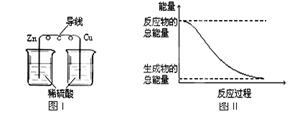 化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
化学能与热能、电能等能相互转化。关于化学能与其他能量相互转化的说法正确的是
A.化学反应中能量变化的主要原因是化学键的断裂与生成
B.铝热反应中, 反应物的总能量比生成物的总能量低
C.图I所示的装置能将化学能转变为电能
D.图II所示的反应为吸热反应
6.下列有关化学反应速率的说法中,正确的是 ( )
A. 100 mL 2 mol/L盐酸与锌反应时,加入100 mL氯化钠溶液,生成氢气的速率不变
B. 对于可逆反应2CO + 2NO 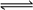 N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快
N2 + 2CO2,使用合适的催化剂,CO的生成速率和消耗速率都加快
C. 二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减慢
D. 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快氢气的产生
5.X、Y、Z、W是原子序数依次递增的4种短周期元素。其中X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z原子的L层电子数比K层与M层电子数之和多5个,W在同周期元素中非金属性最强。下列说法正确的是( )
A. X、Y、Z 3种元素组成的化合物中阴、阳离子所含电子数不等
B. X与Z为同主族元素,它们的单质与W单质反应均失去电子
C. Y、Z、W 3种元素组成的某种化合物可用于消毒
D. Y与Z的单质在常温下反应生成Z2Y2
4.2 mol A与2 mol B混合于2 L的密闭容器中,发生如下反应:2A(g)+3B(g) 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1 B.z=3
C.B的转化率为25% D.C的体积分数为28.6%
3.下列说法正确的是 ( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②同位素的性质几乎完全相同
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
A.①③⑤ B.②④⑤ C.②③④ D.①③
2.下列化学用语表示正确的是 ( )
A. HClO的结构式:H—O—Cl B.四氯化碳的电子式:
 C.CO2的比例模型: D. 乙烯的结构简式:CH2CH2
C.CO2的比例模型: D. 乙烯的结构简式:CH2CH2
一、选择题:
1.形成物质世界多样性的原因有:( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
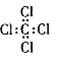 A.仅①②③ B.仅②④⑤
C.仅①③ D.①②③④⑤
A.仅①②③ B.仅②④⑤
C.仅①③ D.①②③④⑤
21. (进度提前,8分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
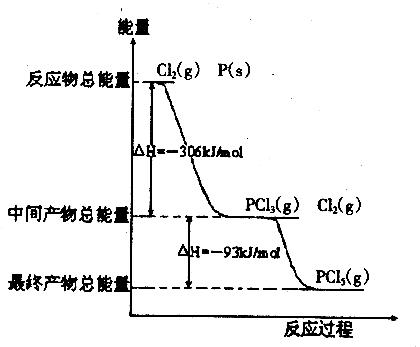
根据上图回答下列问题:
(1)PCl5分解成PCl3和Cl2的热化学方程式为________________________________。
(2)P和Cl2分两步反应生成1molPCl5的△H3=_____________ ,P和Cl2一步反应生成1molPCl5的△H4___________△H3(填“大于”、“小于”或“等于”)。
,P和Cl2一步反应生成1molPCl5的△H4___________△H3(填“大于”、“小于”或“等于”)。
(3) PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________。
PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_________________。

21. (进度没有提前,8分)有硫酸和硝酸的混合溶液100mL,将其平均分为两等份。向其中一份溶液中加入足量的BaCl2溶液,然后将生成的沉淀滤出洗净,烘干称得其质量为9.32g;向另一份溶液中滴加4.00mol·L-1的NaOH溶液25.0mL恰好完全中和。求:
(1)原混合液中硫酸的物质的量浓度;
(2)原混合液中硝酸的物质的量浓度;
(3)若将9.6g铜片投入到原混合液体中,则标准状况下能生成气体多少毫升?
(假设还原产物只有NO)
20. (10分)治理环境污染刻不容缓,建设美丽中国是十八大的奋斗目标。2012年底锂电池总产量超过35亿只,对不可再生的金属资源的消耗是相当大的。因此锂电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:
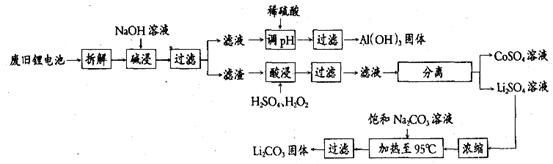
(1)根据上述工艺流程图得出:可回收到的产物除了有Li2CO3,还有_____、_____;
(2)锂电池使用广泛的主要原因是________________________ ______;
______;
(3)废旧电池可能由于放电不完全而残留单质锂,为了安全生产,对拆解环境的要求是_______________________________;
(4)碱浸时主要反应的化学方程式为_______________________;
(5)最后一步过滤应趁热过滤,原因是________________________;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com