
6.下列有关原电池的判断错误的是( )
①所有金属都能作电极 ②有活泼性不同的两种金属电极、有电解质溶液、导线就一定能构成原电池,对外放电 ③原电池放电实现化学能转化为电能 ④以铁、铜为电极,在稀硫酸溶液中构成原电池,负极反应式为Fe-3e-===Fe3+
A.①② B.①③
C.①②④ D.①②③④
解析 钠、钾、钙等极活泼金属易与水、氧气反应,不能作电极,液态汞本身不能作电极,电极必须是导电的固体,①错误;能放电的原电池,必须能自发地发生氧化还原反应,②错误;原电池将化学能转化为电能,③正确;铁作电极,只能生成亚铁离子,④错误。
答案 C
5.伦敦奥运火炬彩用的是环保型燃料——丙烷,其燃烧时发生反应的化学方程式为C3H8+5O2 3CO2+4H2O。下列说法中不正确的是( )
A.火炬燃烧时化学能只转化为热能
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
解析 火炬燃烧时还有化学能与光能的转化,A项错;燃烧都是放热反应;B项对;因为丙烷燃烧为放热反应,所以据反应的化学方程式可知,C项对;丙烷完全燃烧时产物为CO2与H2O,故对环境无污染,D项对。
答案 A
4.下列反应中,反应物总能量一定低于产物总能量的是( )
A.铁在氧气中燃烧
B.氢氧化钡晶体[Ba(OH)2·8H2O]与氯化铵晶体混合
C.锌与稀硫酸反应
D.氢氧化钡溶液与硫酸氢钠溶液混合
答案 B
3.实验室制取氮气的一种方法是在实验装置中引发下列反应:NaNO2+NH4ClN2↑+NaCl+2H2O,反应开始时需要加热,然后停止加热反应仍能进行。下列关于该反应的说法正确的是( )
A.该反应是放热反应
B.该反应是吸热反应
C.开始时,该反应吸热,后来该反应放热
D.上述观点都不正确
解析 一个反应是放热还是吸热,只考虑反应物和产物,不考虑反应过程。该反应在停止加热时继续反应,说明该反应放热。
答案 A
2.如图小试管中盛有几毫升水,与大试管连通的U形细玻璃管内放有少量水(已染成红色)。如沿小试管壁小心地慢慢注入3 mL浓硫酸,静置片刻后,U形细玻璃管中可观察到液面的现象是( )
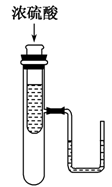
A.左高右低 B.左低右高
C.左右一样高 D.来回振动
答案 B
一、选择题
1.今年世界环境日主题是“促进低碳经济”,《联合国气候变化框架公约》第15次缔约方会议召开,共商2012年至2020年的全球减排协议。下列行为中不符合“促进低碳经济”宗旨的是( )
A.开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料
B.将煤进行气化处理,提高煤的综合利用效率
C.研究采煤、采油新技术,提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
解析 化石燃料(以煤、石油、天然气为主的燃料)属于不可再生能源,且化石燃料的燃烧会产生大量污染物。所以应尽量提高化石燃料的利用率,而不能只专注于产量,故B项正确,C项错误,D项正确。开发新能源,寻找替代品是一种较好的研究方向,A项正确。
答案 C
三、计算题:
21.(7分)某链烃3.6g和Cl2发生取代反应,控制反应条件使其仅生成一氯代物,将反应生成的气体(一氯代物为液体)用NaOH溶液吸收恰好和0.1mol·L-1 NaOH溶液500mL完全反应,试解答下列问题:(1)求该烃的相对分子质量;(2)若该烃既不能使酸性KMnO4溶液褪色,又不能使溴水褪色,试求该烃的分子式。(3)若该烃的一氯代物只有一种,试确定该烃的结构简式 (要求写出计算过程)
20.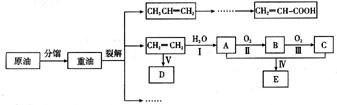 (11分)乙烯是来自石油的重要有机化工原料,
(11分)乙烯是来自石油的重要有机化工原料,
其产量通常用来衡量一个国家的石油化工发展
水平。结合以下路线回答:
已知:
(1)反应II的化学方程式是__________。
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是__________。
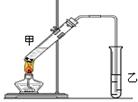 (3)E是有香味的物质,在实验室用下图装置制取。
(3)E是有香味的物质,在实验室用下图装置制取。
①反应IV的化学方程式是__________,该反应类型为______。
②该装置图中有一个明显的错误是 。
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
|
实验编号 |
试管甲中试剂 |
试管乙中 试剂 |
有机层的 厚度/cm |
|
A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 |
饱和Na2CO3 溶液 |
3.0 |
|
B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
|
C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
|
D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
① 实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和_____mol·L-1 。
② 分析实验 (填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
19.(8分)(1)Zn粒和稀盐酸反应一段时间后,反
应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
|
时间/min |
1 |
2 |
3 |
4 |
5 |
|
体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大_______(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为________。
③试分析1~3min时间段里,反应速率变大的主要原因 。
18.(14分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,
回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
⑨ |
⑥ |
⑦ |
|
|
⑧ |
|
(1)由①、②两种元素组成的相对分子质量为28的有机物的空间构型是 ,
该物质与溴水发生加成反应的化学方程式是 。
(2)用电子式表示④的简单氢化物的形成过程如下: ;
(3) 请设计实验比较元素⑥与⑨金属性的相对强弱: _;
(4) 用①元素的单质与④元素的单质可以制成电池,电池中装有KOH浓溶液,将多孔的惰性电极甲和乙浸入KOH溶液中,在甲极通入①的单质,乙极通入④的单质,则甲极的电极反应式为:____________________。
 (5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中①、③、④、⑥、⑧元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为 ,工业上常用单质⑥冶炼难熔的金属,写出氧化铁和单质⑥在高温下反应的化学方程式_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com