
16.在一定温度下,反应2SO2(g)+O2(g)催化剂△2SO3(g)达到平衡时,n(SO2)?n(O2)?n(SO3)=2?3?4。缩小体积,再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2物质的量应是( )
A.0.4 mol B.0.6 mol
C.0.8 mol D.1.2 mol
解析 设平衡时n(SO2)、n(O2)、n(SO3)分别为2x、3x、4x,变化的氧气的物质的量为y,达新平衡时n(SO2)为z,则:
2SO2+O2(g)催化剂△2SO3(g)
平1 2x 3x 4x
变 2y y 2y
平2 z 0.8 mol 1.4 mol
⇒z=0.4 mol。
答案 A
第Ⅱ卷(非选择题,共52分)
15.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列描述正确的是( )
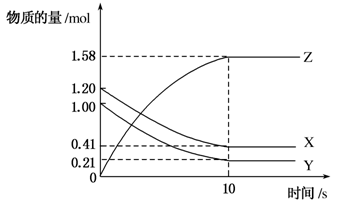
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)Z(g)
解析 由图示可知,在10 s内X、Y、Z物质的量的变化量分别为0.79 mol、0.79 mol、1.58 mol,故反应方程式应为X+Y2Z;Z的反应速率为v(Z)==0.079 mol/(L·s);X的浓度减少了:=0.395 mol/L;Y的转化率为×100%=79%。
答案 C
14.加热A2B5气体按下式分解:
A2B5(g)A2B3(g)+B2(g) ①
A2B3(g)A2B+B2(g) ②
在容积为2 L的密闭容器中将4 mol A2B3加热至t ℃,达到平衡后,B2浓度为0.5 mol·L-1,A2B5浓度为0.7 mol·L-1,则t ℃时A2B3的平衡浓度是( )
A.0.1 mol·L-1 B.0.2 mol·L-1
C.0.9 mol·L-1 D.1.5 mol·L-1
解析 平衡时c(A2B5)=0.7 mol·L-1,就必须有0.7 mol·L-1的B2和0.7 mol·L-1的A2B3参加反应,而平衡时c(B2)=0.5 mol·L-1,就有0.7 mol·L-1+0.5 mol·L-1的A2B3分解,所以平衡时,c(A2B3)=2 mol·L-1-1.2 mol·L-1-0.7 mol·L-1=0.1 mol·L-1。
答案 A
13.CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇
B.正反应和逆反应的化学反应速率均为零
C.CO和H2以1?2的物质的量之比反应生成乙醇
D.反应体系中乙醇的物质的量浓度不再变化
解析 可逆反应的最大限度即化学平衡,可逆反应不能进行到底,A项不正确;化学平衡为动态平衡,正逆反应速率相等且不为零,B项不正确;C项不能说明正逆反应速率相等,不正确。
答案 D
12.一定条件下,在一密闭容器中将1.0 mol/L N2与3.0 mol/L H2合成氨,反应到2 s时测得NH3的浓度为0.8 mol/L,当用氨气浓度的增加来表示该反应速率时,该反应的反应速率为( )
A.0.2 mol/(L·s) B.0.4 mol/(L·s)
C.0.6 mol/(L·s) D.0.8 mol/(L·s)
解析 根据化学反应速率的表示方法:v(NH3)===0.4 mol/(L·s)。
答案 B
11.下列说法正确的是( )
A.化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率
B.在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值
C.同一化学反应中,化学反应速率可用反应物浓度的改变表示,也可用生成物浓度的改变表示,其值可能相同,也可能不同
D.化学反应速率的单位可以是g/(L·s),也可以是kg/(L·s)
解析 由其概念“单位时间内反应物浓度的减小或生成物浓度的增加”,可以看出它适合于所有的化学反应,并非专指可逆反应,故A项不正确;单位时间是正值,反应物浓度的减小或生成物浓度的增加也是正值,故其比值也必为正值,B项不正确;由化学反应速率的计算公式vB=可以看出,其单位中不可能出现g、kg等质量单位,D项不正确。
答案 C
10.对于可逆反应H2(g)+I2(g)2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A.H2(g)的消耗速率与HI(g)的生成速率之比为2?1
B.反应进行的净速率是正、逆反应速率之差
C.正、逆反应速率的比值是恒定的
D.达到平衡时,正、逆反应速率相等
解析 根据化学反应式中物质的化学计量数之比等于对应物质反应速率之比知,氢气消耗速率与HI生成速率之比为1?2,A项错误;反应速率的净速率是较大速率与较小速率之差,可能是逆反应速率与正反应速率之差,或者是正、逆反应速率之差的绝对值,B项错误;外界条件不变时,开始反应:正反应速率大于逆反应速率,比值大于1;平衡时,比值等于1,如果平衡移动,比值随之变化,C项错误;同一物质正、逆反应速率相等时,反应体系中各组分含量保持不变,D项正确。
答案 D
9.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O===CH3COOH+4H+。下列有关说法正确的是( )
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气
C.电池反应的化学方程式为:CH3CH2OH+O2===CH3COOH+H2O
D.正极上发生的反应是:O2+4e-+2H2O===4OH-
解析 电解质溶液中阳离子应向正极移动,A项错误;酸性溶液中,正极电极反应式为O2+4e-+4H+===2H2O,D项错误;结合正极反应式,转移0.4 mol电子时,消耗O2 0.1 mol,其在标准状况下的体积为2.24 L,B项错误,C项正确。
答案 C
8.
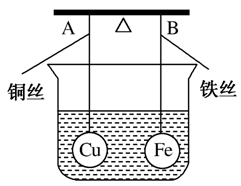
如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和和绝对体时,均为A端低B端高
C.当杠杆为绝对体时,A端低B端高;为导体时,A端高B端低
D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
解析 根据题意,若杆杠为绝缘体,滴入CuSO4溶液后,Cu在铁球表面析出,铁球质量增大,B端下沉;若杠杆为导体,滴入CuSO4溶液后,形成原电池,Cu在铜球表面析出,Fe部分溶解,A端下沉。
答案 D
7.下列电极反应式正确的是( )
A.以惰性材料为电极,以KOH溶液为电解质溶液构成原电池,负极反应式为H2-2e-===2H+
B.铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e-===H2↑
C.以铜为电极将2Fe3++Cu===2Fe2++Cu2+设计成原电池,正极反应式为Cu-2e-===Cu2+
D.以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al-3e-===Al3+
解析 在氢氧化钾溶液中不能生成H+,负极反应式为H2-2e-+2OH-===2H2O,A项错误;铜、锌在稀硫酸中构成原电池,铜极为正极,H+在铜极发生还原反应,B项正确;正极发生还原反应:2Fe3++2e-===2Fe2+,负极发生氧化反应:Cu—2e-===Cu2+,C项错误;铝、铁在氢氧化钠溶液中构成原电池,铝离子继续与OH-反应,负极反应式为Al-3e-+4OH-===AlO+2H2O,D项错误。
答案 B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com