
8、向50mL 18mol/L的硫酸中加入足量的铜片并加热,充分反应后,被还原的硫酸的物质的量 ( )
A. 小于0.45mol B. 等于0.45mol
C. 在0.45mol 和0.9mol之间 D. 等于0.9mol
7、有三个氧化还原反应 ① 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 ② 2FeCl2 + Cl2 =
2FeCl3 ③ 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O 若某溶液中有
Fe2+、I-和Cl-共存,要氧化除去I- 而不影响Fe2+和Cl-,可加入试剂为 ( )
A、Cl2 B、KMnO4 C、FeCl3 D、HCl
6、等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为 ( )
A. 3:4:2 B. 3:3:2 C. 6:7:3 D. 6:9:0
5、等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
4、下列变化需要加入还原剂才能实现的 ( )
A.MnO4-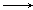 Mn2+ B.HCl
Mn2+ B.HCl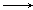 Cl2 C.Fe
Cl2 C.Fe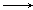 Fe3+ D.KClO3
Fe3+ D.KClO3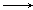 O2
O2
3、能正确表示下列反应的离子方程式是 ( )
A.将铜屑加入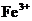 溶液中:
溶液中: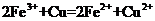
B.将磁性氧化铁溶于盐酸: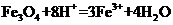
C.将氯化亚铁溶液和稀硝酸混合: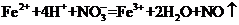
D.将铁粉加入稀硫酸中:
2、用NA表示阿伏德罗常数,下列叙述正确的是 ( )
A.标准状况下,22.4LH2O含有的分子数为1 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,1 NA 个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
一、选择题
1、胶体区别于其它分散系的本质是 ( )
A.胶体的分散质粒子直径在1 nm~100nm之间
B.胶体粒子带电荷并且在一定条件下能稳定存在
C.胶体粒子不能穿过半透膜,能通过滤纸空隙
D.胶体粒子能够发生布朗运动而且能产生丁达尔现象
27.(19分)测定石灰石中钙元素的质量百分含量时,都是先把钙元素全部转化为草酸钙沉淀 (CaC2O4・H2O),然后将草酸钙沉淀 (CaC2O4・H2O),用硫酸溶解,用a
mol/L的标准高锰酸钾溶液滴定生成的草酸,发生化学反应:H2C2O4 +
MnO4- + H+ → Mn2+ + CO2
↑+ H2O(未配平 )。Zxxk
)。Zxxk
(1)配平后离子方程式的系数依次为 、 、 、 、 、 。
(2)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要
的仪器除天平、玻璃棒、烧杯、250mL容量瓶外,还需 。
(3)上述实验中的KMnO4溶液需要酸化,不能使用盐酸酸化的原因是 。
(4)开始取用样品的质量为m g,硫酸溶解后所得草酸溶液的体积为100mL,每次取25.00mL进行滴定,达到滴定终点时所耗KMnO4 溶液体积为
b mL,所得草酸溶液的物质的量的浓度是
;石灰石中钙元素的质 量百分含量为
。(相对原子质量:Ca—40)
量百分含量为
。(相对原子质量:Ca—40)
Zxxk
广东实验中学2012-2013学年 (下)高一级期末考试
26.(13分)依据叙述,写出下列反应的热化学方程式。
(1)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有4NA个电子转移时,放出45 0 kJ的热量。其热化学方程式为______________________。
0 kJ的热量。其热化学方程式为______________________。
(2)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、395 kJ、940 kJ,则N2与H2反应生成NH3的热化学方程式为________________________ ____。
____。
(3)钛(Ti)被称为继铁、铝之后的第三金属,已知由金红石(TiO2)制取单质Ti,涉及的步骤为: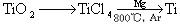
已知:①C(s)+O2(g)  CO2(g); ΔH=-395.5 kJ·mol-1
CO2(g); ΔH=-395.5 kJ·mol-1
②2CO(g)+O2(g)  2CO2(g); ΔH=-560 kJ·mol-1
2CO2(g); ΔH=-560 kJ·mol-1
③TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
TiCl4(s)+2CO(g)的ΔH=―80kJ/mol
则TiO2(s)与Cl2(g)反应的热化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com