
10.(9分)下表是元素周期表的一部分,请回答有关问题:
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
① |
② |
|
③ |
|
|
3 |
|
④ |
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物对应水化物反应的化学方程式 。
(3)设计实验方案:比较⑦与⑩单质氧化性的 强弱,请将方案填入下表。
强弱,请将方案填入下表。
|
实验步骤 |
实验现象与结论 |
|
|
|
解析:本题考查元素周期表的结构和应用。
答案:(1)○ +18
+18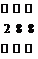 (1分)
(1分)
(2)Al(1分) 2Al+2KOH+2H2 O
O 2KAlO2+3H2↑(3分)
2KAlO2+3H2↑(3分)
(3)(4分)
|
实验步骤(2分) |
实验现象与结论(2分) |
|
将少量氯水加入盛有溴化钠溶液的试管中,振荡后,加入少量四氯化碳,振荡 |
若加入氯水后溶液呈黄色,加入少量四氯化碳后,四氯化碳层呈橙红色,证明单质氯比单质溴氧化性强 |

二、非选择题
9.(8分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物对应水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ,B ,C ,D ,E 。
。
(2)写出A、B两元素最高价氧化物对应水化物相互反应的化学方程式: 。
(3)比较C、D的最高价氧化物对应水化物的酸性:(用化学式表示) 。
解析:本题考查原子结构和元素周期律的知 识。
识。
答案:(1)Na Al Si P Cl(各1分,共5分)
(2)Al(OH)3+NaOH NaAlO2+2H2O(2分)
NaAlO2+2H2O(2分)
(3)H3PO4>H2SiO3(1分)
8.(2012山东理综,9)下列关于原子结构、元素性质的说法正确的是( )。
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金 属性最强的元素
属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
解析:非金属元素组成的化合物中可能含有离子键,如NH4Cl,A项错误;根据同一周期从左往右,元素的金属性逐渐减弱可知,B项正确;有的元素有同位素,如16O和18O,这两种原子的质子数相同,但中子数不同,C项错误;根据元素周期律可知,ⅦA族元素的阴离子的还原性越强,则其最高价含氧酸的酸性越弱,D项错误。
答案:B
第Ⅱ卷(非选择题 共36分)
7.下列说法正确的是( )。
A.第二周期元素从C到F,非金属性逐渐减弱
B.第三周期元素从Na到Cl,原子半径逐渐增大
C.HF、HCl、HBr、HI的热稳定性依次逐渐减弱
D.LiOH、NaOH、KOH的碱性依次逐渐增强
解析:A中非金属性逐渐增强;B中原子半径逐渐减小;C、D两项正确。
答案:CD
6.下列说法中错误的是( )。
A.质子数相同的原子,其核外电子排布也相同
B.质量数相同的不同原子,其化学性 质一定相同
质一定相同
C.金属性越强,其原子在反应中越易得到电子
D.非金属性越强,其阴离子越难失去电子
解析:质子数相同的原子,其核外电子数也相同,核外电子排布相同,A对;质量数相同的不同原子一定不是同种元素,B错;金属性越强,其原子失电子能力越强,阳离子得电子能力越弱,C错;非金属性越强,其原子得电子能力越强,其阴离子失电子能力越弱,D对。
答案:BC
5.短周期的三种元素X、Y、Z,已知X元素的原子核外只有一个电子,Y元素的原子M层上的电子数是它的内层电子总数的一半,Z元素原子的L层上的电子数比Y元素原子的L层上的电子数少2个,则这三种元素所组成的化合物的化学式不可能是( )。
A.X2YZ4 B.XYZ3
C.X3YZ4 D.X4Y2Z7[来源:学|科|网]
解析:根据题目所给条件可知:X为氢元素,Y为磷元素,Z为氧元素,根据磷元素的价态一般为+5价可以判断三种元素所组成的化学式不可能为A。
答案: A
A
4.医学研究证明,用放射性 I治疗肿瘤可收到一定疗效,下列有关
I治疗肿瘤可收到一定疗效,下列有关 I叙述正确的是( )。
I叙述正确的是( )。
A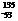 I是碘的一种同素异形体
I是碘的一种同素异形体
B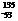 I是一种新发现的元素
I是一种新发现的元素
C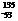 I位于元素周期表中第四周期ⅦA族
I位于元素周期表中第四周期ⅦA族
D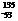 I核内的中子数与核外电子数之差为29
I核内的中子数与核外电子数之差为29
解析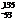 I是碘的一种核素,位于元素周期表的第五周期ⅦA族A、B、C错;中子数与核外电子数之差为135-53-53=29。
I是碘的一种核素,位于元素周期表的第五周期ⅦA族A、B、C错;中子数与核外电子数之差为135-53-53=29。
答案:D
3.下列说法正确的是( )。
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.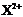 的核外电子数目为18,则X在第四周期第ⅡA族
的核外电子数目为18,则X在第四周期第ⅡA族
解析:最活泼的金属在周期表的左下方,为Fr,最活泼的非金属是F,A错;Mg(OH)2碱性比Ca(OH)2弱,B错;元素周期表共有18个纵行,C错;D中X是钙元素,D正确。
答案:D
2.下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )。
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.089 |
0.102 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.L2+与R2-的核外电子数相等
B.M与T形成的化合物既能与酸反应又能与强碱反应
C.氢化物的稳定性为H2T<H2R
D.单质与浓度相等的稀盐酸反应的速率为Q>L
解析:根据R和T的化合价及原子半径可以推测:R是硫元素,T是氧元素,再根据Q、T、L的半径关系可以推测出 Q是铍元素,L是镁元素,再根据L、M的半径关系和化合价推测M是铝元素。M
Q是铍元素,L是镁元素,再根据L、M的半径关系和化合价推测M是铝元素。M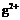 和
和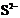 的核外电子数不相等,A错;Al2O3既能与酸反应又能与强碱反应,B正确;氢化物的稳定性H2S<H2O,C错;单质与浓度相同的盐酸反应的速率Be<Mg,所以D错误。
的核外电子数不相等,A错;Al2O3既能与酸反应又能与强碱反应,B正确;氢化物的稳定性H2S<H2O,C错;单质与浓度相同的盐酸反应的速率Be<Mg,所以D错误。
答案:B
一、选择题
1.下列说法正确的是( )。
A.NaCl固体中含有共价键
B.CO2分子中含有离子键
C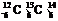 C是碳元素的三种核素
C是碳元素的三种核素
D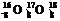 O含有相同的中子数
O含有相同的中子数
解析:本题考查化学键、核素和原子结构的有关概念,NaCl中只有离子键,CO2中只有共价键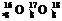 O中含有相同的质子数,中子数不相同。
O中含有相同的质子数,中子数不相同。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com