
8.(10分)(2012·海南高考改编)已知反应A(g)+B(g) C(g)+D(g)在830℃条件下,达到平衡时生成物和反应物的关系式
C(g)+D(g)在830℃条件下,达到平衡时生成物和反应物的关系式 为一个常数,数值为1。
为一个常数,数值为1。
(1)830℃时,向一个5 L密闭容器中充入0.20 mol的A和0.80 mol的B。
①如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=
________ mol·L-1,C的物质的量为 mol。
②若反应经过一段时间后,达到平衡时A的转化率为 。
(2)判断该反应是否达到平衡的依据为 (填正确选项前的字母)。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
答案解析
二、非选择题
7.(10分)某学生为了探究锌与盐酸反应过程中速率变化,在100 mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
|
时间(min) |
1 |
2 |
3 |
4 |
5 |
|
氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)在0 min~1 min、1 min~2 min、2 min~3 min、3 min~4 min、4 min~
5 min时间段中,反应速率最大的时间段是 ,原因为 ;
反应速率最小的时间段是 ,原因为 。
(2)在2 min~3 min时间段内,用 盐酸的浓度变化表示的反应速率为 。
盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是 。
A.蒸馏水 B.Na2SO4溶液 C.NaNO3溶液
D.CuSO4溶液 E.Na2CO3溶液
6.(能力挑战题)对一定温度下的恒容容器中的可逆反应A(g)+3B(g) 2C(g),下列叙述不能作为平衡标志的是( )
2C(g),下列叙述不能作为平衡标志的是( )
①C的生成速率与C的分解速率相等;
②单位时间内生成amol A,同时生成3amol B;
③A、B、C的浓度不再变化;
④A、B、C的压强不再变化;
⑤混合气体的总压强不再变化;
⑥混合气体的物质的量不再变化;
⑦单位时间内消耗amol A,同时生成3amol B;
⑧A、B、C的分子数之比为1∶3∶2。
A.②⑧ B.①⑥ C.②④ D.③⑧
5.(2012·福建高考)一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是( )
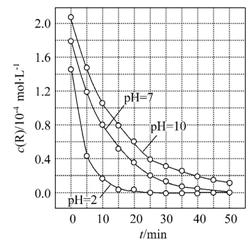
A.在0 min~50 min之间,pH=2和pH=7时R的降解百分率相 等
等
B.溶液酸性越强,R的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在20 min~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
4.(双选)(2013·遵义高一检测)在一定条件下,使NO和O2在一密闭容器中进行反应2NO+O2 2NO2,下列说法中不正确的是( )
2NO2,下列说法中不正确的是( )
A.反应开始时,正反应速率最 大,逆反应速率为零
大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,正反应速率逐渐减小,逆反应速率逐渐增大
D.随着反应的进行,逆反应速率逐渐增大,最后比正反应速率还大
3.(2013·德州高一检测)把下列四种X溶液分 别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地
别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地 进行反应,其中反应最快的是( )
进行反应,其中反应最快的是( )
A.20℃30 mL 2 mol·L-1的X溶液
B.10℃20 mL 3 mol·L-1的X溶液
C.20℃10 mL 4 mol·L-1的X溶液
D.10℃10 mL 2 mol·L-1的X溶液
2.在2 L容积不变的容器中,发生N2+3H2 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s时容器中N2的物质的量是( )
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol·L-1·s-1,则10 s时容器中N2的物质的量是( )
A.1.6 mol B.2.8 mol
C.3.2 mol D.3.6 mol
一、选择题
1.下列关于可逆反应的说法中正确的是( )
A.可逆反应就是既 能向正反应方向进行,又能向逆反应方向进行的化学反应
能向正反应方向进行,又能向逆反应方向进行的化学反应
B.在催化剂的作用下,二氧化硫与氧气反应生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,因此该反应是可逆反应
C.对于合成氨的反应,如果调控好反应条件,可使一种反应物的转化率达到100%
D.碳酸钙在高温下分解生成氧化钙和二氧化碳,氧化钙和二氧化碳 在常温下生成碳酸钙,因此这两个反应是可逆反应
在常温下生成碳酸钙,因此这两个反应是可逆反应
12.(8分)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系)。
|
实验步骤 |
实验 现象 现象 |
|
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
|
②向新制得的Na2S溶液中滴加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
|
③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
|
④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体 |
|
⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
⑥向AlCl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验内容:(填写与实验步骤对应的实验现象的编号)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象(填A~F) |
|
|
|
|
|
|
(2)实验结论: 。
解析:本题考查第三周期元素的性质及金属性、非金属性强弱的比较方法。
答案:(1)(每空1分,共6分)
|
实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
|
实验现象 |
B |
F |
A |
C |
D |
E |
(2)金属性:Na>Mg>Al(1分),非金属性Cl>S(1分)或:同周期元素随着核电 荷数的递增,金
荷数的递增,金 属性逐渐减弱,非金属性逐渐增强(2分)
属性逐渐减弱,非金属性逐渐增强(2分)
11.(11分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1 mol E单质与足量酸作用,在标准状况下能产生33.6 L H2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,D的单质与水反应的方程式为
。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,
有关反应的离子方程式为 。
解析:设A、B、C、D四种元素原子的电子数分别为x-8、x-1、x、x+1,则(x-8)+(x-1)+x+(x+1)=56,x=16,A、B、C、D分别为O、P、S、Cl。根据1 mol E与足量酸反应生成的H2的体积为33.6 L,可知E为铝元素。
答案:(1)Al2O3(1分)
(2)P2O5(1分) 硫(1分) Cl2+H2O HCl
HCl +HClO(2分)
+HClO(2分)
(3)先有白色胶状沉淀 产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清(2分)
产生并逐渐增多,随NaOH溶液的加入又逐渐溶解最终澄清(2分)
Al3++3OH- Al(OH)3↓(2分),Al(OH)3+OH-
Al(OH)3↓(2分),Al(OH)3+OH- Al
Al +2H2O(2分)
+2H2O(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com