
34.(11分)①Cl-对反应没有影响,而SO42-对反应具有阻碍作用(1分);②Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)(1分)。③反应速率加快(1分) ;④反应速率减慢(1分)⑤酸式滴定管(1分,只回答“滴定管”不得分)⑥100mL(2分)⑦100mL容量瓶、玻璃棒(2分,每项1分,漏掉100mL扣1分)⑧消耗完相同质量的铝片需要的时间(或相同的时间内消耗铝片的质量)(2分)。或相同的时间里收集到的氢气的体积(或者收集相同体积的氢气所消耗的时间)(其他答案合理同样给分)
四、
33、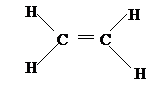 (1)
(1)
(1分)
(2)羟基;羧基 (每空1分,共2分 )
(3)(共6分。化学方程式每空1分,化学式错误,没配平0分;反应类型每空1分,错别字0分。)
①CH2=CH2 + H2O CH3CH2OH (加成反应)
CH3CH2OH (加成反应)
②2CH3CH2OH + O2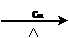 2CH3CHO
+ 2H2O (氧化反应)
2CH3CHO
+ 2H2O (氧化反应)
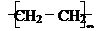 ③nCH2=CH2
③nCH2=CH2
 (聚合反应)
(聚合反应)
(二)(1)NaOH (2)HCl (3)C
32、(共10分)
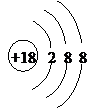 (1)Ar
(1)Ar
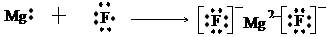 (2)Al (3)
(2)Al (3)
(4)HClO4 KOH Al(OH)3
(5)2Al + 2NaOH + 2H2O =2 NaAlO2+ 3H2↑
Al (OH)3+ OH- = AlO2-+ 2H2O
(6)34;H2S
(一)(每空1分)
|
|
是否正确 |
简述理由 |
|
学生1的观点 |
否 |
海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀。 |
|
学生2的观点 |
否 |
能源消耗大,海水的综合利用低,成本高。 |
|
学生3的观点 |
是 |
镁离子富集浓度高,成本低。 |
三、
31、(13分)
一、选择题
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
B |
A |
C |
B |
A |
B |
C |
C |
C |
D |
C |
D |
D |
|
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
D |
D |
D |
A |
A |
D |
B |
D |
D |
C |
C |
D |
|
|
26 |
27 |
28 |
29 |
30 |
|
A |
D |
A |
A |
A |
(三)为了使实验“定量化”、使结果更精确,可以对实验进行如下改进:
1.配制c(H+)相同的稀盐酸和稀硫酸:现有浓度为1mol·L-1的盐酸和密度为1.225g·cm-3、质量分数为20%的硫酸,若要准确量取该硫酸20.00mL,需要用⑤ (填仪器名称);将量取的硫酸配制成c(H+)=1mol·L-1的溶液,可得溶液的体积为⑥ 。
配制溶液时还需要用到的玻璃仪器有⑦ 、烧杯、胶头滴管和量筒等。
2.比较反应速率:反应时间可以用秒表测定。如果要对上述实验中的反应速率进行比较,可以通过测定哪些物理量来确定?要求回答一种即可。⑧ 。
35.(5分)冶炼金属常用以下几种方法:①以C、CO或H2做还原剂 ②以活泼金属Na、Mg等还原 ③利用铝热反应原理还原 ④电解法 ⑤热分解法。下列金属各采用哪种方法还原最佳。(用序号填写下列空白。)(共10分)
(1)Fe、Zn、Cu等中等活泼金属 。
(2)Na、Mg、Al等活泼或较活泼金属 。
(3)Hg、Ag等不活泼金属 。
(4)V、Cr、Mn、W等高熔点金属 。
(5)K、Rb、Cs、Ti等金属通常还原方法是 。
36、 (10分).如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
(10分).如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
⑴ 四座工厂排出的废水里含有的污染物分别为:
甲 ;乙 ;
丙 ;丁 。(填化学式)
⑵ 在丁的下游M处取出的河水中,肯定含有的离
子是 。
⑶ 写出有关反应的离子方程式: 。
⑷ 小河中鱼、虾几乎绝迹的原因是 。
高一化学必修二期末考试试题答案及评分标准
(二)该同学取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
1.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
2.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验1中③ ,实验2中④ ,则说明原因Ⅲ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
(一)该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:① ;
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com