
36.[化学选修——2:化学与技术](15分)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为
mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为
mol。
(3)海水提镁的一段工艺流程如下图:

浓海水的主要成分如下:
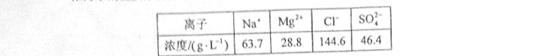
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
28.(15分)某小组以CoCl2·6H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 ml c1 mol·L-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 ml NaOH溶液。
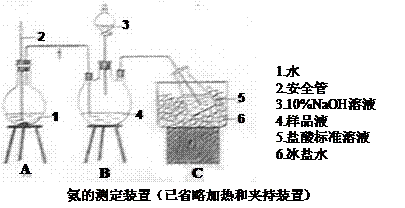
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 :滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1 ,c(CrO42-)为 mol·L-1 mol。(已知:Ksp(Ag2CrO4)= 1.12×10-12)
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为 。制备X的化学方程式为 :X的制备过程中温度不能过高的原因是 。
27.(15分)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在周期表的位置为 周期,第 族:PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 :PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式 ,阴极观察到的现象是 :若电解液中不加入Cu(NO3)2,阴极发生的电极反应式 ,这样做的主要缺点是 。
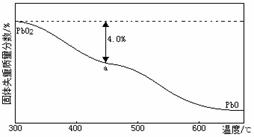
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%( )的残留固体,若a点固体表示为PbO2或mPbO2·nPbO2,列式计算x值和m:n值
。
)的残留固体,若a点固体表示为PbO2或mPbO2·nPbO2,列式计算x值和m:n值
。
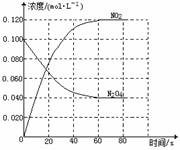
26.(13分)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
13.室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3 C.△H1+△H3=△H2 D.△H1+△H2>△H3
12. 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是( )
A.a为电池的正极
B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
11.一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
10.下列图示实验正确的是( )

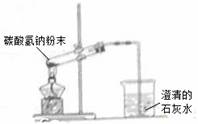
A.除去粗盐溶液中的不溶物 B.碳酸氢钠受热分解
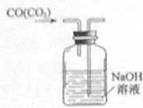

C.除去CO气体中的CO2气体 D.乙酸乙酯制备演示实验
9.下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
8.四联苯 的一氯代物有( )
的一氯代物有( )
A.3种 B.4种 C.5种 D.6种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com