
5.后来,我国专家认为,兰新铁路在该区域的选线不合理,理由可能是
A.线路过长 B.距城镇过远
C.易受洪水威胁 D.工程量过大
4.推测外国专家在图示区域铁路选线时考虑的主导因素是
A.河流 B.聚落 C.耕地 D.地形
3.若在北回归线上建一太阳能光热电站,其高塔正午影长于塔高的比值为P,则
A.春、秋分日P=0 B. 夏至日P=1
C.全年P<1 D. 冬至日P>1
20世纪50年代,在外国专家的指导下,我国修建了兰新铁路。兰新铁路在新疆吐鲁番附近的线路如图2所示。读图2,完成4~6题。
2.太阳能光热电站可能会
A.提升地表温度 B.干扰飞机电子导航
C.误伤途径飞鸟 D.提高作物产量
1.我国下列地区中,资源条件最适宜建太阳能光热电站的是
A.柴达木盆地 B.黄土高原 C.山东半岛 D.东南丘陵
33.(17分)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:____________
②设计实验方案:在不同H2O2浓度下,测定____________________________________(要求所测得的数据能直接体现反应速率大小)。
② 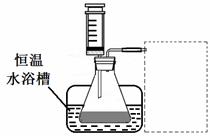 计实验装置,完成图20的装置示意图。
计实验装置,完成图20的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
|
物理量 实验序号 |
V[0.1 mol·L-1Fe2(SO4)3]/mL |
|
…… |
|
1 |
a |
|
…… |
|
2 |
a |
|
…… |
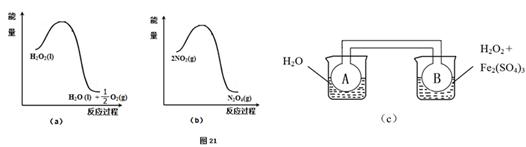
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
32.(16分)石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
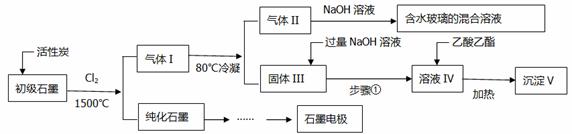
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
 (1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,气体I中的碳氧化物主要为________________________,由气体II中某物质得到水玻璃的化学反应方程式为_________________。
(3)步骤①为:搅拌、________、所得溶液IV中的阴离子有_______________。
(4)由溶液IV生成沉淀V的总反应的离子方程式为___________________,100kg初级石墨最多可获得V的质量为___________kg。
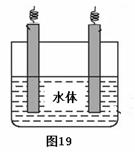
(5)石墨可用于自然水体中铜件的电化学防腐,完成图19防腐示意图,并作相应标注。
31.(16分)
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应。
①
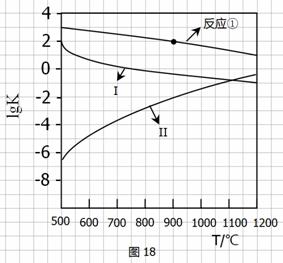 1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1
1/4CaSO4(s)+CO(g)⇋1/4CaS(s)+CO2(g) ∆H1=-47.3kJ∙mol-1
② CaSO4(s)+CO(g)⇋CaO(s)+CO2(g) +SO2(g) ∆H2=+210.5kJ∙mol-1
③ CO(g)⇋1/2C(s)+1/2CO2(g) ∆H3=-86.2kJ∙mol-1
(1)反应2CaSO4(s)+7CO(g)⇋CaS(s)+ CaO(s)+6CO2(g)+ C(s) +SO2(g)的∆H=___________(用∆H1、∆H2和∆H3表示)
(2)反应①-③的平衡常数的对数lgK随反应温度T的变化曲线见图18,结合各反应的∆H,归纳lgK-T曲线变化规律:
a)_______________________________;b)____________________________。
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0X10-5 mol∙L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字)。
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入____________。
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为_______________;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为________________。
30.(15分)不饱和酯类化合物在药物、涂料等应用广泛。
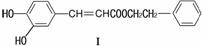 (1)下列化合物I的说法,正确的是______。
(1)下列化合物I的说法,正确的是______。
A.遇FeCl3溶液可能显紫色
B.可发生酯化反应和银镜反应
C.能与溴发生取代和加成反应
D.1mol化合物I最多能与2molNaOH反应
(2)反应①是一种由烯烃直接制备不饱和酯的新方法:

化合物II的分子式为____________,1mol化合物II能与_____molH2恰好完全反应生成饱和烃类化合物。
(3)化合物II可由芳香族化合物III或IV分别通过消去反应获得,但只有II能与Na反应产生H2,II的结构简式为________(写1种);由IV生成II的反应条件为_______。
(4)聚合物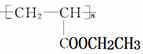 可用于制备涂料,其单体结构简式为____________________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为____________________________________________________。
可用于制备涂料,其单体结构简式为____________________。利用类似反应①的方法,仅以乙烯为有机物原料合成该单体,涉及的反应方程式为____________________________________________________。
23. 甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.乙的单质在空气中燃烧生成只含离子键的化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com