
37.读材料回答问题(20分)
材料一:西藏地区等降水量线分布图。

材料二:青稞是藏族同胞主要食粮,雅鲁藏布江谷地是我国青稞的主要产区之一。
材料三:2011年8月17日上午,中国科学院国家天文台西藏羊八井观测站揭牌仪式在海拔4300米的西藏羊八井举行。
(1)简析西藏羊八井开展天文观测的有利条件。(8分) 。
(2)5月是攀登珠峰最佳季节,分析原因。(6分)
(3)根据青稞分布,推测其生长习性。(6分)
必考题
36.(26分)根据图文资料,回答以下问题。
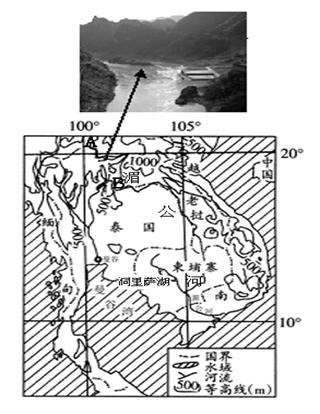 材料一:洞里萨湖位于柬埔寨西部。每年12月至次年6月为枯水季节,洞里萨湖面积2700—3000平方千米;7至11月湖面扩大到1万平方千米以上。
材料一:洞里萨湖位于柬埔寨西部。每年12月至次年6月为枯水季节,洞里萨湖面积2700—3000平方千米;7至11月湖面扩大到1万平方千米以上。
材料二: 澜沧江—湄公河是亚洲最重要的跨国水系。2012年9月,中国、老挝、缅甸、泰国澜沧江—湄公河商船通航协调联合委员会会议召开,对航运管理等议题进行了深入讨论,并达成共识。
材料三:湄公河流域图
(1)分析湄公河上游A—B段河道特征及成因(8分)
(2)分析制约湄公河上游航运自然因素(8分)
(3)简析洞里萨湖湖面季节变化明显的原因。(10分)
36.(18分)
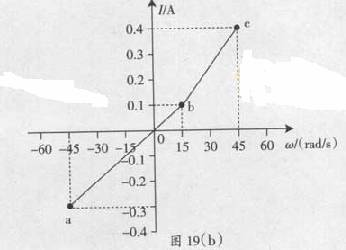
如图19(a)所示,在垂直于匀强磁场B的平面内,半径为r的金属圆盘绕过圆心O的轴转动,圆心O和边缘K通过电刷与一个电路连接,电路中的P是加上一定正向电压才能导通的电子元件。流过电流表的电流I与圆盘角速度ω的关系如图19(b)所示,期中ab段和bc段均为直线,且ab段过坐标原点。ω>0代表圆盘逆时针转动。已知:R=3.0Ω,B=1.0T,r=0.2m。忽略圆盘、电流表和导线的电阻
(1) 根据图19(b)写出ab、bc段对应I与ω的关系式
(2) 求出图19(b)中b、c两点对应的P两端的电压Ub、Uc
(3) 分别求出ab、bc段流过P的电流Ip与其两端电压Up的关系式

2013年普通高等学校招生全国统一考试(广东卷)
34.(18分)(1)研究小车匀速直线运动的实验装置如图16(a)所示其中斜面倾角θ可调,打点计时器的工作频率为50HZ,纸带上计数点的间距如图16(b)所示,七中每相邻两点之间还有4个记录点未画出。

① 部分实验步骤如下:
A. 测量完毕,关闭电源,取出纸带
B. 接通电源,待打点计时器工作稳定后放开小车
C. 将小车依靠在打点计时器附近,小车尾部与纸带相连
D. 把打点计时器固定在平板上,让纸穿过限位孔
上述实验步骤的正确顺序是: (用字母填写)
② 图16(b)中标出的相邻两计数点的时间间隔T= s
③ 计数点5对应的瞬时速度大小计算式为V5= 。
④
 为了充分利用记录数据,减小误差,小车加速度大小的计算式应为a=
为了充分利用记录数据,减小误差,小车加速度大小的计算式应为a=
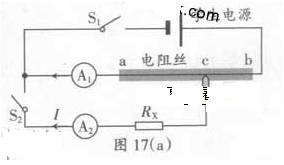
(2)图17(a)是测量电阻RX的原理图。学生电源输出电压可调,电流表量程选0.6A(内阻不计),标有长度刻度的均匀电阻丝ab的总长为30.0cm
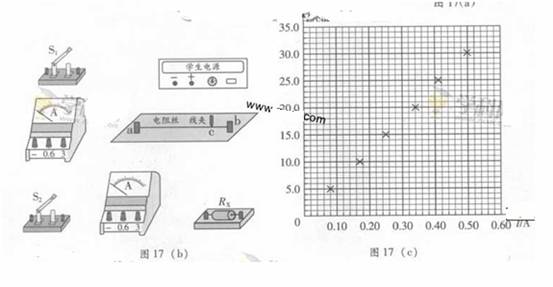
① 根据原理图链接图17(b)的实物图
② 断开S2,合上S1;调节电源输出电压为3.0V时,单位长度电阻丝为电压
u= V/cm.记录此时电流表A1的示数。
③ 保持S1闭合,合上S2;滑动c点改变ac的长度L,同事调节电源输出电压,使电流表A1的示数与步骤②记录的值相同,记录长度L和A2的示数I。测量6组L和I值,测量数据已在图17(c)中标出,写出RX与L、I、u的关系式RX= ;根据图17(c)用作图法算出RX= Ω
35图18,两块相同平板P1、P2至于光滑水平面上,质量均为m。P2的右端固定一轻质弹簧,左端A与弹簧的自由端B相距L。物体P置于P1的最右端,质量为2m且可以看作质点。P1与P以共同速度v0向右运动,与静止的P2发生碰撞,碰撞时间极短,碰撞后P1与P2粘连在一起,P压缩弹簧后被弹回并停在A点(弹簧始终在弹性限度内)。
 P与P2之间的动摩擦因数为μ,求
P与P2之间的动摩擦因数为μ,求
(1) P1、P2刚碰完时的共同速度v1和P的最终速度v2;
(2) 此过程中弹簧最大压缩量x和相应的弹性势能Ep
33.(17分)
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
① 列收集Cl2的正确装置时 。

②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2) 能量之间可以相互转化:点解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
 限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
① 完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
② 铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③ 甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
32.银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下的:

(1)电解精练银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为
(2)固体混合物B的组成为 ;在省城固体B的过程中,余姚控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: 。
。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液 L.
(5)CuSO2溶液也可用于制备胆矾,其基本操作时 、过滤、洗涤和干燥。
31.(16分)
大气中的部分碘源于O3对海水中Ⅰ-的氧化。将O3持续通入NaⅠ溶液中进行模拟研究.
(1)O3将Ⅰ-氧化成Ⅰ2的过程由3步反应组成:
①Ⅰ-(aq)+ O3(g)=ⅠO-(aq)+O2(g)△H1
②ⅠO-(aq)+H+(aq)  HOⅠ(aq) △H2
HOⅠ(aq) △H2

总反应的化学方程式为______,其反应△H=______
(2)在溶液中存在化学平衡: ,其平衡常数表达式为_______.
,其平衡常数表达式为_______.
(3) 为探究Fe2+对氧化Ⅰ-反应的影响(反应体如图13),某研究小组测定两组实验中Ⅰ3-浓度和体系pH,结果见图14和下表。
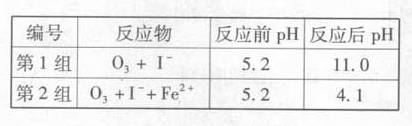
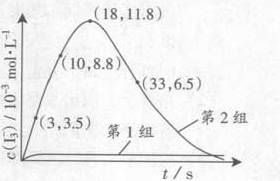
① Ⅰ组实验中,导致反应后pH升高的原因是_______.
② 图13中的A为_____由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是_______.
③第2组实验进行18s后,Ⅰ3-下降。导致下降的直接原因有双选______.
A.C(H+)减小 B.c(Ⅰ-)减小 C. Ⅰ2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3-13s内第2组实验中生成l3-的平均反应速率(写出计算过程,结果保留两位有效数字)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com