
11. (14分)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(14分)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,
25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,
其平均反应速率v(NO3—)为 mol ∙L—1 ∙min—1
③还原过程中可生成中间产物 ,写出3
,写出3
种促进 水解的方法 。
水解的方法 。
(2)电化学降解 的原理如题11图所示。
的原理如题11图所示。
①电源正极为 (填“A”或“B”),
阴极反应式为 。
②若电解过程中转移了2mol电子,则膜两侧
电解液的质量变化差(△m左-△m右)为 g。
2013年普通高等学校招生全国统一考试(重庆卷)
理科综合能力测试试卷
生物部分(共90分)
10.(15分)华法林是一种治疗心脑血管疾病的药物,可由化合物E和M在一定条件下合成得到(部分反应条件略)。

(1) A的名称为 ,A→B的反应类型为 。
(2)
D→E的反应中,加入的化合物X与新制 反应产生红色沉淀的化学方程式为 。
反应产生红色沉淀的化学方程式为 。
(3) G→J为取代反应,其另一产物分子中的官能团是 。
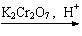

 (4) L的同分异构体Q是芳香酸,Q R(C8H7O2Cl)
S
T,T的核磁共振氢谱只有两组峰,Q的结构简式为
。
(4) L的同分异构体Q是芳香酸,Q R(C8H7O2Cl)
S
T,T的核磁共振氢谱只有两组峰,Q的结构简式为
。
(5) 题10图中,能缩合成体型高分子化合物的酚类单体是 。

(6) 已知:L→M的原理为 ① C6H5OH+C2H5OCR C6H5OCR+C2H5OH和
② R1CCH3+C2H5OCR2 R1CCH2CR2+C2H5OH,M的结构简式为 。
9.(15分)某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)

题9图
(1)MgCO3的分解产物为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
|
步骤 |
操作 |
甲组现象 |
乙组现象 |
|
1 |
取黑色粉末加入盐酸 |
溶解,无气泡 |
溶解,有气泡 |
|
2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
|
3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
|
4 |
取步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是 。
②甲组步骤1中反应的离子方程式为 。
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 。
④从实验安全考虑,题9图装置可采取的改进措施是 。
39.0g,则合金中Cu的质量分数
为 。
② 为分析某铜合金的成分,用酸将
其完全溶解后,用NaOH溶液调
pH,当pH=3.4时开始出现沉淀,
分别在pH为7.0、8.0时过滤沉
淀。结合题8图信息推断该合金
中除铜外一定含有 。
8.(14分)合金是建造航空母舰的主体材料。
(1) 航母升降机可由铝合金制造。
① 铝元素在周期表中的位置为 。工业炼铝的原料由铝土矿提取而得。提取过程中通入的气体为 。
② Al-Mg合金焊接前用NaOH溶液处理Al2O3膜,其化学方程式为 。
焊接过程中使用的保护气为 (填化学式)。
(2) 航母舰体为合金钢。
① 舰体在海水中发生的电化学腐蚀主要为 。
② 航母用钢可由低硅生铁冶炼而成,则在炼铁过程中为降低硅含量需加入的物质为 。
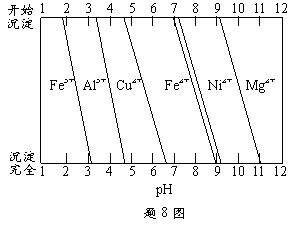 (3) 航母螺旋桨主要用铜合金制造。
(3) 航母螺旋桨主要用铜合金制造。
① 80.0gCu-Al合金用酸完全溶解后,
加入过量氨水,过滤得白色沉淀
7.将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
 压强/MPa 压强/MPa 体积分数/% 体积分数/%温度/℃ |
1.0 |
2.0 |
3.0 |
|
810 |
54.0 |
a |
b |
|
915 |
c |
75.0 |
d |
|
1000 |
e |
f |
83.0 |
① b<f ② 915℃、2.0MPa时E的转化率为60%
③ 该反应的△S>0 ④ K(1000℃)>K(810℃)
上述①~④中正确的有
A.4个 B.3个 C.2个 D.1个
1.2c kJ∙mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+ PCl3(g)=4PCl5(g)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1
6.已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为
5.有机物X和Y可作为“分子伞”给药载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)。

H2NCH2CH2CH2NHCH2CH2CH2CH2NH2
X(C24H40O5) Y
下列叙述错误的是
A.1mol X在浓硫酸作用下发生消去反应,最多生成3mol H2O
B.1mol Y发生类似酯化的反应,最多消耗2mol X
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y和癸烷的分子链均呈锯齿形,但Y的极性较强
4.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物:

下列说法错误的是
A.步骤(1)需要过滤装置 B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚 D.步骤(4)需要蒸馏装置
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com