
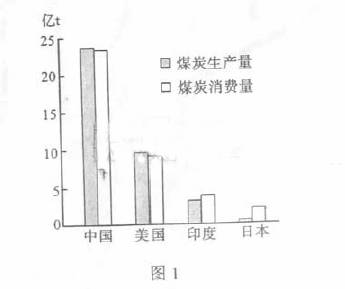
1、图示四个国家中,人均煤炭消费量最高的是
A.中国 B.美国
C.印度 D.日本
3.第I卷共35小题,每小题4分,共140分。在每题给出的四个选项中,只有一项是符合题目要求的。
图1示意2008年中国、美国、印度、日本四个国家的煤炭生产量和消费量。读图1并根据所学知识,完成1-2题。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,在试题卷上作答无效。
31.(20分)花生是我国的主要农作物,对花生的生长发育、生理和遗传变异等方面的研究,将
有助于提高花生等农作物的产量。
Ⅰ.(8分)研究者在苗期选择着生位置相同、叶色各异的花生叶片,同时测定了叶片的净光
合速率和叶绿素含量,结果如题31图1、图2。请回答下列问题:
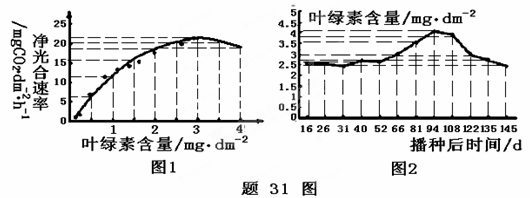
(1)叶绿素主要分布在叶绿体的 ▲ 上。
(2)结合图1、图2分析,在花生播种后第81天时,叶片净光合速率大约为 ▲
mg CO2·dm-2·h-1。
(3)叶片净光合作用速率最高时出现在播种后的第 ▲ 天。
(4)叶绿素含量最高时,净光合作用速率并不是最高,原因可能是 ▲ 。
Ⅱ.(12分)现有开橙黄色花和百花的二个花生品种分别种植在实验田一和实验田二中,如题31
图所示,请回答有关问题:
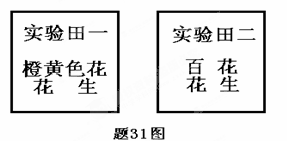
(1)花生种子萌发成幼苗变绿前,萌发过程中的营养物质是由种子中的 ▲ 提供,
萌发过程中种子的干重将 ▲ ,原因是 ▲ 。
(2)杂交实验时,如果用实验田一橙黄色花花生作母本,百花花生作父本,开花期将采取 的措施是:首先在花蕾期对 ▲ (填实验田一或实验田二)的花生进行 ▲ ,再套袋,待花成熟后进行人工授粉,再套袋,最后收获种子。将此种子播种后,长成的植株都开橙黄色花,说明橙黄色为 ▲ 性状。
附件1:律师事务所反盗版维 权声明
权声明

附件2:独家资源交 换签约
换签约 学校名录(放大查看)
学校名录(放大查看)
学校名录 参见
参见 :http://www./wxt/list.aspx?ClassID=3060
:http://www./wxt/list.aspx?ClassID=3060
30.(22分)题30图为人体食物消化、营养物质吸收和运输、组织细胞内的代谢和代谢废物排
出体外的过程简图,请据图回答下列有关问题:
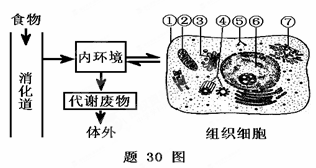
(1)人体进食经消化后,营养物质被吸收进入内环境,导致血糖浓度升高。假设图示组织
细胞为胰岛细胞,此时活动会加强的细胞器是 ▲ (填图中番号)。目的是
增加血浆中 ▲ 浓度,维持血糖平衡。
(2)食物蛋白质经消化后吸收进入内环境,再进入组织细胞被 利用。第一,可用于合成人
利用。第一,可用于合成人
体血红蛋白,人体血红蛋白由574个氨基酸4条多肽链组成,那么,在组织细胞⑤中
合成一分子血红蛋白时至少产生 ▲ 分子水;第二,
 可用于 ▲ 作用
可用于 ▲ 作用
合成14种非必需氨基酸,但此作用不能合成成人的8种必需氨基酸,原因是 ▲ 。
(3)营养物质运输到 ▲ ( 填组织器官)时,可用于合成催乳素,催乳素能
填组织器官)时,可用于合成催乳素,催乳素能
调控动物对幼仔的照顾行为,此行为属于 ▲ 行为。
(4)人体进入寒冷环境时, ▲ 激素和肾上腺素分泌量增加,图中组织细胞内的
▲ (填图中番号)活动加强,耗氧量 ▲ ,皮肤血管收缩,
 汗腺分泌活动减弱等来实现体温的相对衡定。
汗腺分泌活动减弱等来实现体温的相对衡定。
(5)人体血浆PH的正常值为7.35~7.45,当人体摄入过酸的食物时,血浆中的缓冲物质
 ▲ 就会与进入血浆的酸性物质反应,使血浆PH维持正常水平。
▲ 就会与进入血浆的酸性物质反应,使血浆PH维持正常水平。
29.(18分)A、B、C、D四种短周期元素,原子序数依次增大。已知:
①A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合
物X和Y,X和水反应生成一种具有还原性的二元酸M,M可以使溴水褪色。
②A元素的单质和C元素的单质化合可生成Z,Z在加热条件下跟水反应的产物1mol需用
3mol KOH才能完全中和。
③A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单
质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1) 画出元素D的离子结构示意图: ▲ 。
(2) A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):
▲
(3)M可以使溴水褪色,写出该反应的离子方程式: ▲
(4)写出Z与热水反应的化学方程式:
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂的物质的量之比为1:1,该反应
的离子方程式为 ▲
(6)脱除天然气中D的氢化物既能减少环境污染,又可回收D单质。用过量NaOH溶液吸收D
的氢化物后,以石墨作电极电解该溶液回收D单质,电解总反应的化学方程式(忽略溶解
氧的氧化还原反应)为
 ▲
;
▲
;
该方法的优点是 ▲
28.(14分) 某化学兴趣小组欲验证:“铜和一定量的浓硝酸反应有一氧化氮产生”。设计使用了
如下装置进行实验。(假设气体体积均为标准状况,导气管中气体体积忽略不计,且忽略反
应中的溶液体积变化)
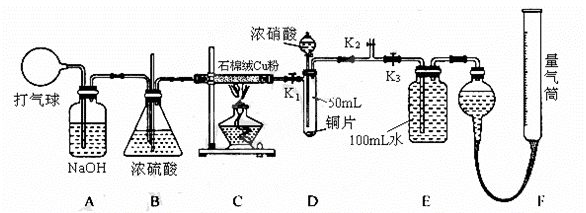
试回答下列问题:
(1) 将铜粉分散在石棉绒中的原因是__________________▲_________________。
(2) 在铜和浓硝酸反应前,挤压打气球,经A、B 、C反应后,进入D中的气体主要成分是____▲_____(填化学式),通入该气体的目的是____________▲___
、C反应后,进入D中的气体主要成分是____▲_____(填化学式),通入该气体的目的是____________▲___ ___________;进行此步操作时应关闭_____▲____,打开____▲_____ (填K1、K2或K3)。
___________;进行此步操作时应关闭_____▲____,打开____▲_____ (填K1、K2或K3)。
(3) 关闭K1、K2,打开K3,由分液漏斗向D中滴加 浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:
浓硝酸。待Cu和浓硝酸反应结束后,再通过分液漏斗向D中加入CCl4至满。则D中一定发生反应的离子方程式为:
__________________________________▲____________________________________
(4) 从E装置所得溶液中取出25.00mL,加两滴酚酞,用0.1000 mol·L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则E容器中所得硝酸的物质的量浓度为_________▲_________ mol·L-1。
(5) 若实验测得F装置所收集到的气体体积为139.00 mL,则铜和一定量的浓硝酸反应_____▲______(填“有”或“无”)NO生成,
27.(14分)A~M均代表中学化学中常见物质,它们具有如下转化关系。已知反应①②③是
某化工生产的反应原理;反应④是工业上生产玻璃原理之一。B、C、G常温下呈气态,I
遇苯酚溶液呈现紫色;H在过量的L溶液中生产白色胶状沉淀M。
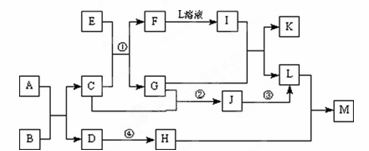
根据以上信息回答下列问题:
(1)写出E的化学式为 ▲ ;A和B反应生产1 mol C,转移电子物质的量为 ▲ mol。
(2)I与G反应的离子方程式为 ▲ 。
(3)反应④的化学方程式为 ▲ ,
该反应涉及到 ▲ 种晶体类型。
(4) 已知3.2 g G与C完全反应生产气态J放出Q kJ的热量,则该反应的热化学方程式为:
▲ ,工业上完成该反应的设备名称是 ▲ 。
(5)K中加入足量NaOH溶液并放置一段时间,反应过程的现象为 ▲ 。
26.(14分)一定条件下铁可以和CO2发生反应:
 Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
Fe(s)+CO2(g) FeO(s)+CO(g);△H>0
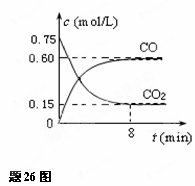 (1) 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
(1) 一定温度下,向某密闭容器中加入足量铁粉并充入一定量的
CO2气体,反应过程中CO2 气体和CO气体的浓度与时间
的关系如图所示.
求8分钟内CO的平均反应速率v(CO)= ▲ .
(2) 下列措施中能使平衡时c(CO)/c(CO2)增大的是 ▲
(填序号).
A.升高温度 B.增大压强
C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO2,则CO2的转化率将
▲ (填“增大”、“减小”、“不变”).
(4)铁的重要化合物在生产生活中应用十分广泛,高铁酸钠(Na2FeO4)作为水处理剂兼具絮凝
剂和消毒杀菌剂的作用,被科学家们公认为绿色消毒剂。
① 实验室采用次氯酸盐氧化法制高铁酸钠,在次氯酸钠溶液中加入氢氧化钠和硫酸铁,可制
备高铁酸钠的稀溶液,该反应的离子方程式是 ▲
 ② 高铁酸盐还可用于可充电电池。高铁电池与普通高能电池相比,能长时间保持稳定的放电
② 高铁酸盐还可用于可充电电池。高铁电池与普通高能电池相比,能长时间保持稳定的放电
电压。高铁电池的总反应为:
3Zn + 2K2FeO4 + 8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
该电池充电时,阳极的电极反应是 ▲
放电时,每有1 mol K2FeO4被还原,转移电子的数目为
▲ (用NA表示,NA表示
(用NA表示,NA表示
阿伏伽德罗常数)
25.如题25图所示,为一个实验室模拟货物传送的装置,A是一个表面绝缘质量为1kg的小车,
小车置于光滑的水平面上,在小车左端放置一质量为0.1kg带电量为q=1×10-2C的绝缘货柜,
现将一质量为0.9kg的货物放在货柜内.在传送途中有一水平电场,可以通过开关控制其有、
无及方向.先产生一个方向水平向右,大小E1=3×102N/m的匀强电场,小车和货柜开始运动,
作用时间2s后,改变电场,场强大小变为E2=1×102N/m,方向水平向左,电场作用一段时间
后,关闭电场,小车正好到达目的地,货物到达小车的最右端,且小车和货物的速度恰好为
零。已知货柜与小车间的动摩擦因数µ=0.1,(小车不带电,货柜及货物体积大小不计,g取
10m/s2)求:
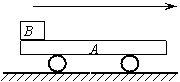 ⑴第二次电场作用的时间;
⑴第二次电场作用的时间;
⑵小车的长度;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com