
14. 如图所示,图(a)中的变压器为理想变压器,其原线圈接到U=220 V的交流电源上,副线圈与阻值为R1的电阻接成闭合电路;图(b)中阻值为R2的电阻直接接到电压为U=220 V的交流电源上,结果发现R1与R2消耗的电功率恰
如图所示,图(a)中的变压器为理想变压器,其原线圈接到U=220 V的交流电源上,副线圈与阻值为R1的电阻接成闭合电路;图(b)中阻值为R2的电阻直接接到电压为U=220 V的交流电源上,结果发现R1与R2消耗的电功率恰 好相等,则变压器原、副线圈的匝数之比为 ( )
好相等,则变压器原、副线圈的匝数之比为 ( )
A.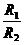 B.
B.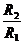
C. 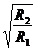 D.
D.
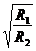
13.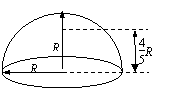 如图所示,一只半球形碗倒扣在水平桌面上处于静止状态,球的半径为R,质量为m的蚂蚁只有在离桌面的高度大于或等于R时,才能停在碗上,
如图所示,一只半球形碗倒扣在水平桌面上处于静止状态,球的半径为R,质量为m的蚂蚁只有在离桌面的高度大于或等于R时,才能停在碗上, 若最大静摩擦力等于滑动摩擦力,那么蚂蚁和碗面间的动摩擦因数为( )
若最大静摩擦力等于滑动摩擦力,那么蚂蚁和碗面间的动摩擦因数为( )
A. B. C. D.
32.(13分)[化学——有机化学基础]
下图是利用丙烯和对二甲苯合成有机高分子材料W的转化关系示意图。
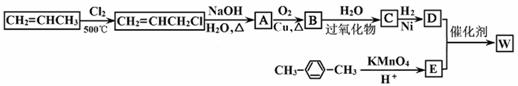
已知:①B可以发生银镜反应,C不含甲基,1mol D与足量钠可生成22.4L H2(标准状况下)。
②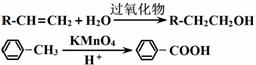
(1)B→C反应类型为 。
(2)C的结构简式为
(3)C物质不具有下列 性质(填数字序号)。
①与金属钠反应 ②酯化反应 ③水解反应 ④氧化反应 ⑤还原反应
(4)写出D与足量金属钠反应的化学方程式: 。
(5)写出W的结构简式 。
(6)写出满足以下条件的一个E的同分异构体:___________________。
①遇FeCl3溶液显紫色 ②可发生银镜反应 ③可与NaHCO3溶液生成CO2
2014考前理综物理适应性试卷(定稿)
31.[化学—物质结构与性质] (13分)
硼化合物种类丰富,用途广泛。结合下列信息回答问题:
Ⅰ、硼酸能够吸收中子,屏蔽核辐射。其水溶液呈弱酸性,机理是:硼酸与水作用时,硼原子与水电离产生的OH— 以配位键结合形成Y-离子,导致溶液中C(H+)>c( OH—)。硼酸晶体具有层状结构,每一层结构如下图所示。
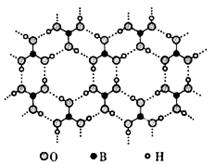
(1) 硼酸晶体属于 (填“离子晶体”、“分子晶体”或“原子晶体”) 。
(2) 硼酸晶体中,微粒间的存在的作用力有 。
A.金属件 B.共价键 C.离子键 D..配位键 E.氢键 F. 范德华力
(3)三氟化硼(BF3)水解生成硼酸和氟硼酸(H[BF4]),该反应的化学方程式为:
。
(4) 下列关于硼酸的说法正确的是 。
A.H3BO3是一元酸
B.其水溶液中,水的电离平衡受到抑制
C.晶体中有氢键,因此硼酸分子较稳定
D.分子中B与O原子均达到8电子稳定结构
E.1 mol H3BO3晶体中含有3 mol氢键
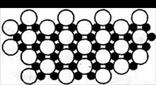
Ⅱ、科学家发现硼化镁在39K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图a是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。
(5)根据图示确定硼化镁的化学式为 。
 |
 |
|
图a |
图b |
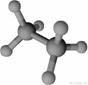
Ⅲ、氨硼烷(NBH6)是一种有效、安全的固体储氢材料。氨硼烷的结构如图b和乙烷相似。
(6)氨硼烷分子与硼酸分子中硼原子的杂化轨道类型分别为 和 。
25.(15分)四氯化锡(SnCl4)常用于印染和电镀工业。
[实验Ⅰ] 金属Sn的制备
(1)以锡石SnO2为原料,用足量 的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为 。
的焦炭作还原剂,在高温下可制得粗锡,该反应的化学方程式为 。
(2)粗锡经电解精炼可得纯锡,精炼时粗锡连接电源的 (填正、负极)。[实验Ⅱ] SnCl4的制备
某兴趣小组用下图装置,用熔融的金属锡11.9克与干燥纯净的氯气制取无水SnCl4,此反应过程放出大量的热。
已知:①Sn的熔点:231℃
②SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解
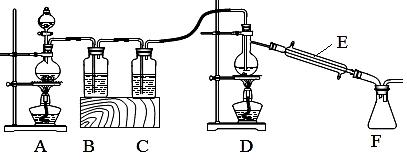
(3)装置A中反应的离子方程式为 。
(4)装置B中应加入试剂为____________________。
(5)反应开始生成SnCl4后,可以先熄灭D处的酒精灯,理由是 。
(6)有同学认为该实验装置设计有两处明显缺陷,其中一处应在F装置后再连接
(填符号)装置,选择的理由是 。
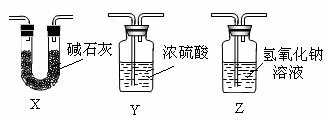
(7)实验装置改进后若在F中收集到20.9克SnCl4 ,则锡的利用率约为 。
24.(16分)铈、铬、铝等金属元素,在工业生产中有着重要的作用。
Ⅰ、(1)二氧化铈 (CeO2)是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应
用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,H2O2在该反应中作
(填“氧化剂”“还原剂”“催化剂”)。
(2)自然界六价Cr能引起细胞的突变和癌变。可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:
____Cr2O72-+____SO32-+____H+=____Cr3++____SO42-+ ______
Ⅱ、工业上用粉碎的煤矸石(主要含Al2O3、SiO2及铁的氧化物)制备净水剂BAC
[Al2(OH)nCl6-n]的流程如下:
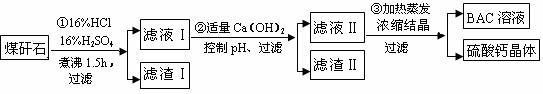
(3)粉碎煤矸石的目的是 。
(4)滤渣Ⅰ的主要成分是 (填名称)。
(5)步骤①在煮沸的过程中,溶液逐渐由无色变为绿色,随后溶液又变为棕黄色,
请写出溶液绿色变为棕黄色的离子反应方程式为 。
(6)步骤②中控制pH,要使Fe3+完全除去即c(Fe3+)降低到10-5mol•L-1,溶液的pH至少应升高到 (已知常温下Ksp[Fe(OH)3] =1.0×10-36.8)。
(7)已知BAC的分散质粒子大小在1~100nm之间,由此区别滤液Ⅰ与BAC两种液体的物理方法是________________________ 。
(8)若Ca(OH)2溶液过量,则步骤③得到的BAC产率偏低,写出该反应的
离子方程式 。
23.(14分)SO2、NOx、CO2是对环境影响较大的气体,控制和治理SO2、NOx、CO2是
减少酸雨、光化学烟雾和解决温室效应的有效途径。
(1)碳元素在元素周期表的位置: 。
(2)标况下2.24LSO2恰好被1L 0.2mol·L-1的NaOH溶液完全吸收,请写出吸收后溶液中离子浓度由大到小的顺序为 。
(3)已知汽车尾气NO 与CO净化反应生成无污染气体,3g NO参加该反应放出37.99 kJ热量,请写出该反应的热化学方程式: 。
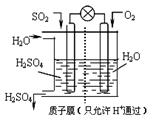 (4)某科研小组想以如图所示装置用原电池将 SO2转化
(4)某科研小组想以如图所示装置用原电池将 SO2转化
为重要的化工原料。
①其负极反应式: ,
②当有1mol SO2被吸收,则通过质子(H+)交换膜的
H+离子数为 。
(5)某科研小组用CO2通过下面反应方程式来生产甲醇,
CO2(g)+3H2(g)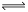 CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH= —49.0kJ·mol-1
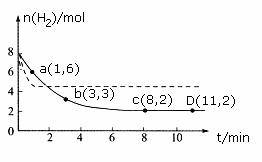 现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。
现将6molCO2和8molH2充入一容积为2L的恒温密闭容器中,测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)。
回答下列问题:
①此温度下该反应的平衡常数的数值K= 。
②仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,虚线改变的条件可能是 。
12.反应N2(g)+3H2(g) 2NH3(g) ΔH <0,在其他条件不变的情况下,下列说法正确的是
2NH3(g) ΔH <0,在其他条件不变的情况下,下列说法正确的是
A.增加氮气的量,平衡正向移动,上式中ΔH增大
B.增大压强,平衡正向移动,平衡常数增大
C.升高温度,平衡逆向移动,正反应速率增大
D.加入催化剂,反应速率增大,氢气转化率增大
11.利用化石燃料开采、加工过程产生的H2S废气通过电化学法制取氢气的工艺如图,
下列说法不正确的是:
A.反应池中的离子方程式:2Fe3++S2—=2Fe2++S↓
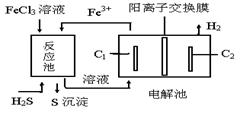 B.该工艺优点之一是FeCl3溶液可循环利用
B.该工艺优点之一是FeCl3溶液可循环利用
C.电解池中惰性电极C1为阳极
 D.电解池总反应的化学方程式:
D.电解池总反应的化学方程式:
10.25℃时,某溶液中含有Na+、H+、Fe3+、HCO3-、OH-、I-中的几种离子,
已知由水电离出的c(H+)=1.0×10-13 mol·L-1。向该溶液中缓慢通入一定量的Cl2后,溶液由无色变为黄色。下列关于该溶液的分析,错误的是
A.pH=l 或 pH=13
B.阴离子肯定有I—,不能确定有无HCO3—
C.阴离子肯定没有Fe3+,不能确定有无Na+
D.溶质有3种可能:①HI ②HI和NaI ③NaI和NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com