
24. (11分)某化学兴趣小组对“制镁企业不能使用CO2灭火器作为消防器材”的问题进行探究,请你参与他们的活动。
(11分)某化学兴趣小组对“制镁企业不能使用CO2灭火器作为消防器材”的问题进行探究,请你参与他们的活动。
⑴二氧化碳的制备
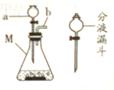
用右图所示实验装置制备CO2,写出仪器M 的名称:______;
的名称:______;
组装时,仪器a、b插入双孔橡皮塞的先后顺序是_____(填序号);
若将长颈漏斗换为分液漏斗,其优点是___________________。该反应选用CaCO3与稀盐酸制取CO2,请写出反应的化学方程式:_______________________。
⑵探究镁与二氧化碳的反应
兴趣小组同学将点燃的镁条插入盛满CO2的集气瓶内,镁条继续剧烈燃烧,生成白色固体并有黑色物质附着于集气瓶内壁。同学们对镁与CO2反应的产物继续进行探究。
[提出猜想]
猜想Ⅰ:产物是MgO和C;
猜想Ⅱ:产物是MgO、MgC2和C。
提出以上猜想 的依据是_______________________。
的依据是_______________________。
[查阅资料]MgO+ H2O=Mg(OH)2,Mg(OH)2在热水中的溶解度增大;
H2O=Mg(OH)2,Mg(OH)2在热水中的溶解度增大;
MgC2+2H2O=Mg(OH)2+C2H2↑。
[实验分析]为探究白色固体的成分,兴趣小组同学进行了如下实验:
①取少量反应后的固体混合物放入试管,加入足量热水,无气体放出,说明猜想_______不正确;
②为了验证另一种猜想中白色固体成分,请设计一个简单实验。
实验操作_______________;
实验现象_______________。
若该猜想正确,此时Mg与CO2反应的类型属于_______________。
[实验反思]通过本实验,对“CO2不助燃”,你有什么新的认识:______________。
23.(8分 )要实现“化学——让生活更美好”,必须保护环境,倡导低碳生活。试回答下列问题:
)要实现“化学——让生活更美好”,必须保护环境,倡导低碳生活。试回答下列问题:
|
物质 |
大气中的含量(体积百分比) |
温室效应指数 |
|
H2O |
1 |
0.1 |
|
CO2 |
0.03 |
1 |
|
CH4 |
2×10-4 |
30 |
CCl 3F 3F |
2.8×10-8 |
21000 |
|
CCl2F2 |
4.8×10-8 |
25000 |
⑴上表中列出了五种气体的“温室效应指数”,指数越大,温室作用越强。综合分析表中数据,引起温室效应的最主要的气体是___________;表中属于有机物的有_______种。
⑵低碳经济是以低碳污染、低能耗、低排放为基础的经济模式。
①汽车尾气中含有NOx、CO等污染物,加装尾气催化净化装置,可以使其中的NOx、CO相互反应转化成无毒的________和CO2,实验室检验CO2的化学方程式为______________________________。
②乙醇汽油作为汽车燃料可以减少碳排放,乙醇(C2H5OH)中碳元素的质量分数为______;目前,人们正在开发________________作为新能源,以实现“二氧化碳零排放”。
③垃圾的有效处理也是实现低碳生活的重要手段,请从“垃圾是放错了位置的资源”的角度,提出你对垃圾处理的建议:____________________。
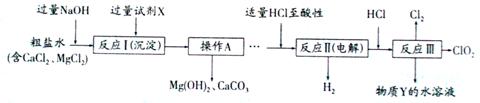
22. (6分) 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
(6分) 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图,其中反应Ⅲ制取ClO2的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
|
 ⑵分析完成反应Ⅱ的化学方程式: _____NaCl+_____H2O ______________。
⑵分析完成反应Ⅱ的化学方程式: _____NaCl+_____H2O ______________。
⑶为提高经济效益,生产过程中除将H2和Cl2制成HCl充分利用外,还可循环使用的物质Y是_________。
二、填空与简答题
21.(7分)了解物质的结 构,有利于理解和认识化学问题。
构,有利于理解和认识化学问题。
⑴下表为部分元素的原子结构示意图:
|
元素名称 |
氢 |
氦 |
氮 |
氧 |
钠 |
硫 |
|
元素符号 |
H |
He |
N |
O |
Na |
S |
|
原子结构示意图 |
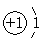 |
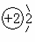 |
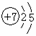 |
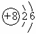 |
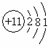 |
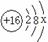 |
请回答下列问题:
①表中硫原子的最外层电子数X=____;若X=8,请写出该离子的符号_____。
②表中具有相对稳定结构的原子是________(填符号)。
③钠与硫反应过程中,钠原子因失去最外层1个电子达到相对稳定结构,显+1价。试解释NaOH中H显-1价的原因是_____________ _______________。
_______________。
④上述元素组成的酸有多种,试写出由三种元素组成的酸的化学式:________
(任写一种)。
⑵高温条件下,NH3在O2中用铂-铑合金(Pt-Rh)催化氧化。若催化机理如下图所示:
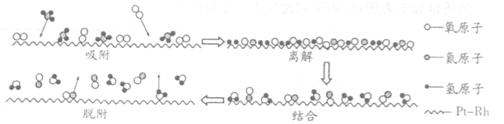
试写出该反应的化学方程式:________________________________。
10.(14分)金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3
(s) + 3H2 (g)  W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴ 上述反应的化学平衡常数表达式为___________________________。
⑵ 某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为___________反应(填“吸热”或“放热”)。
⑶ 上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
|
温度 |
25℃ ~
550℃ ~
600℃ ~
700℃ |
|
主要成份 |
WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)  W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
WO2 (g) + 2H2  W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
则WO2
(s)  WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。
⑸ 钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s)
+2I2 (g)  WI4 (g)。下列说法正确的有________________。
WI4 (g)。下列说法正确的有________________。
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢








绝密★启用前
2012年普通高等学校招生全国统一考试(天津卷)
9.(18分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
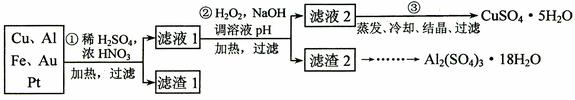
请回答下列问题:
⑴ 第①步Cu与酸反应的离子方程为____________________________________;
得到滤渣1的主要成分为___________________。
⑵ 第②步加H2O2的作用是_____________________,使用H2O2的优点是___________________________;调溶液pH的目的是使________________________________________生成沉淀。
⑶ 用第③步所得CuSO4·5H2O制备无水CuSO4的方法是________________________________________。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案:
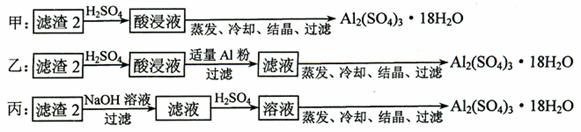
上述三种方案中,_________________方案不可行,原因是_____________________________:
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol L-1 EDTA(H2Y2--)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如下:Cu2+ + H2Y2- = CuY2+- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡 c.未除净可与EDTA反应的干扰离子
8.(18分)萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:
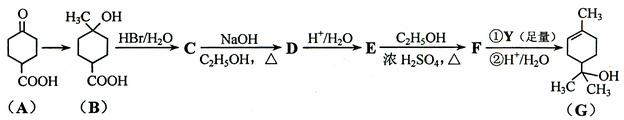
已知:RCOOC2H5
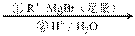
请回答下列问题:
⑴ A所含官能团的名称是________________。
⑵ A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
_______________________________________________________________。
⑶ B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
① 核磁共振氢谱有2个吸收峰 ② 能发生银镜反应
(4) B → C、E → F的反应类型分别为_____________、_____________。
⑸ C → D的化学方程式为____________________________________________。
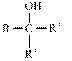
⑹ 试剂Y的结构简式为______________________。
⑺ 通过常温下的反应,区别E、F和G的试剂是______________和_____________。
⑻ G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。
7.(14分)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为________________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是_______________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:
______________________________________________________。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
 2Z +
FeG2
2Z +
FeG2 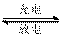 Fe + 2ZG
Fe + 2ZG
放电时,电池的正极反应式为__________________________:
充电时,______________(写物质名称)电极接电源的负极;
该电池的电解质为___________________。
6.已知2SO2 (g) + O2
(g)  2SO3 (g);ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是 ( )
2SO3 (g);ΔH = -197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2 ;(丙) 2 mol SO3 。恒温、恒容下反应达平衡时,下列关系一定正确的是 ( )
A.容器内压强P:P甲=P丙 > 2P乙 B.SO3的质量m:m甲=m丙 > 2m乙
C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙D.反应放出或吸收热量的数值Q:Q甲=G丙 > 2Q乙
2012年普通高等学校招生全国统一考试(天津卷)
理科综合 化学部分
第Ⅱ卷
5.下列电解质溶液的有关叙述正确的是 ( )
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含l mol KOH的溶液与l mol CO2完全反应后,溶液中c(K+)=c(HCO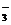 )
)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com