
一、单项选择题
1.物理学的发展是许多物理学家奋斗的结果,下面关于一些物理学家的贡献说法正确的是( )
A.安培通过实验发现了通电导线对磁体有作用力,首次揭示了电与磁的联系
B.奥斯特认为安培力是带电粒子所受磁场力的宏观表现,并提出了著名的洛伦兹力公式
C.库仑在前人工作的基础上通过实验研究确认了真空中两个静止点电荷之间的相互作用力遵循的规律——库仑定律
D.安培不仅提出了电场的概念,而且采用了画电场线这个简洁的方法描述电场
答案 C
解析 奥斯特将通电导体放在小磁针上方时,小磁针发生了偏转,说明通电导体周围存在磁场,奥斯特是第一个发现了电与磁之间的联系的物理学家,故A错误;洛伦兹认为安培力是带电粒子所受磁场力的宏观表现,并提出了洛伦兹力公式,故B错误;真空中两个点电荷间存在相互的作用.库仑利用扭秤装置,研究出两个静止点电荷间的相互作用规律:点电荷间的相互作用力跟两个点电荷的电荷量有关,跟它们之间的距离有关,这个规律就是库仑定律,故C正确;19世纪30年代,法拉第提出电荷周围存在一种场,并且是最早提出用电场线描述电场的物理学家,故D错误.所以选C.
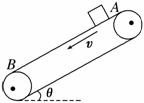
6.如图所示,一皮带输送机的皮带以v=13.6 m/s的速率做匀速运动,其有效输送距离AB=29.8 m,与水平方向夹角为θ=37°。将一小物体轻放在A 点,物体与皮带间的动摩擦因数μ=0.1,求物体由A到B所需的时间。
5.如图所示,质量为m=1.0kg的小滑块(可视为质点)放在质量为M=2.0kg的长木板的左端,木板放在光滑水平面上,滑块与木板之间的动摩擦因数为μ=0.5,,木板长L=1.5m,开始时两者都处于静止状态。取g=10m/s2,试求:
(1)用水平力F拉小滑块,要使得小滑块不从木板上掉下来,力F应满足什么条件?
(2)用水平恒力F拉小滑块向木板的右端运动,在1.0s末使滑块从木板右端滑出,力F应为多大?
 (3)若地面粗糙,且木板与地面间的动摩擦因素μ1=0.1,若要使得小滑块和木板以共同的速度运动,求拉力F应满足的条件。
(3)若地面粗糙,且木板与地面间的动摩擦因素μ1=0.1,若要使得小滑块和木板以共同的速度运动,求拉力F应满足的条件。
4.如图所示,光滑水平面上静止放着长L=4 m,质量为M=3 kg的木板(厚度不计),一个质量为m=1 kg的小物体放在木板的最右端,m和M之间的动摩擦因数μ=0.1,今对木板施加一水平向右的拉力F,(g取10 m/s2)
(1)为使两者保持相对静止,F不能超过多少?
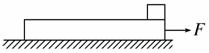 (2)如果F=10
N,求小物体离开木板时的速度?
(2)如果F=10
N,求小物体离开木板时的速度?
3.如图所示,质量为80kg的物体放在安装在小车上的水平磅秤上,小车在平行于斜面的拉力F作用下沿斜面无摩擦地向上运动, 现观察到物体在磅秤上读数为1000 N。已知斜面倾角θ=30°,小车与磅秤的总质量为20 kg。(g=10 m/s2)
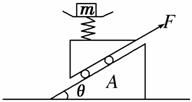 (1)拉力F为多少?
(1)拉力F为多少?
(2)物体对磅秤的静摩擦力为多少?
2. 如图所示,光滑水平面上放置质量分别为m、2m和3m的三个木块,其中质量为2m和3m的木块间用一不可伸长的轻绳相连,轻绳能承受的最大拉力为FT。现用水平拉力F拉质量为3m的木块,使三个木块以同一加速度运动,则以下说法正确的是( )
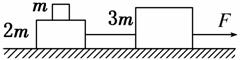 A.质量为2m的木块受到四个力的作用
A.质量为2m的木块受到四个力的作用
B.当F逐渐增大到FT时,轻绳刚好被拉断
C.当F逐渐增大到1.5FT时,轻绳还不会被拉断
D.轻绳刚要被拉断时,质量为m和2m的木块间的摩擦力为FT
1.[双选]如图所示,小车运动时, 看到摆球悬线与竖直方向成θ角并与小车保持相对静止,则下列说法中正确的是 ( )
A.小车可能向右加速运动,加速度为gsinθ
 B.小车可能向右减速运动,加速度为gtanθ
B.小车可能向右减速运动,加速度为gtanθ
C.小车可能向左加速运动,加速度为gtanθ
D.小车可能向左减速运动,加速度为gtanθ
29.(15分)已知:①CH3CH===CHCH2CH3①KMnO4、OH-②H3O+ CH3COOH+CH3CH2COOH
②R—CH===CH2HBr过氧化物R—CH2—CH2—Br
香豆素的主要成分是芳香内酯A,A经下列步骤转化为水杨酸。
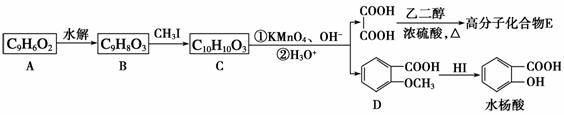
请回答下列问题:
(1)下列有关A、B、C的叙述中不正确的是________。
a.C的核磁共振氢谱中共有8组峰
b.A、B、C均可发生加聚反应
c.1 mol A最多能与5 mol氢气发生加成反应
d.B能与浓溴水发生取代反应
(2)B分子中有2个含氧官能团,分别为__________和__________(填官能团名称),B→C的反应类型为________________________________________________________。
(3)在上述转化过程中,反应步骤B→C的目的是_______________________________。
(4)化合物D有多种同分异构体,其中一类同分异构体是苯的对二取代物,且水解后生成的产物之一能发生银镜反应。请写出其中一种的结构简式:________________________。
(5)写出合成高分子化合物E的化学反应方程式:________________________________。
(6)写出以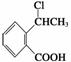 为原料制
为原料制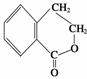 的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用),并注明反应条件。合成路线流程图示例如下:
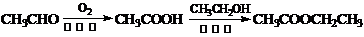
28.(15分)镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉和氧化铁等涂在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行回收研究,设计实验流程如下:
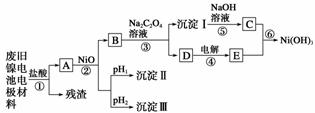
已知:a.NiCl2易溶于水,Fe3+不能氧化Ni2+。
b.某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
|
M(OH)n |
Ksp |
开始沉淀pH |
沉淀完全pH |
|
Al(OH)3 |
1.9×10-23 |
3.43 |
4.19 |
|
Fe(OH)3 |
3.9×10-28 |
2.53 |
2.94 |
|
Ni(OH)2 |
1.6×10-14 |
7.60 |
9.75 |
回答下列问题:
(1)根据表中数据判断步骤②依次析出沉淀Ⅱ________和沉淀Ⅲ________(填化学式),则pH1________pH2(填“>”、“=”或“<”),控制两种沉淀析出可利用________(填序号)。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O,则步骤③的化学方程式是
________________________________________________________________________。
步骤③后,过滤沉淀所需的玻璃仪器有____________。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:__________________,_________________。
(3)④中阳极反应产生的气体E为________,验证该气体的试剂为__________________。
(4)试写出步骤⑥的离子方程式:_________________________________________。
27.(15分) (1)在恒温恒容密闭容器中进行合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1,下列选项中能表示该反应达到平衡状态的是________(填字母序号)。
2NH3(g) ΔH=-92 kJ·mol-1,下列选项中能表示该反应达到平衡状态的是________(填字母序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H—H键的同时形成3a个N—H键
e.三种物质的浓度之比恰好等于化学方程式中各物质的化学计量数之比
(2)草酸(H2C2O4)是一种二元弱酸,主要用作还原剂和漂白剂。40 ℃时混合一定体积的0.1 mol·L-1 H2C2O4溶液与一定体积0.01 mol·L-1酸性KMnO4溶液,填写表中空格。
|
温度 |
v(H2C2O4) |
v(KMnO4) |
KMnO4褪色时间 |
|
40 ℃ |
10
mL |
10
mL |
40
s |
|
40 ℃ |
20
mL |
20
mL |
|
(3)氮元素的另一种气态氢化物肼可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成
的。与肼分子具有相同电子数的分子有多种,其中具有可燃性的物质是__________(填一种物质的化学式)
肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g) ΔH1=-1 038.7 kJ·mol-1,若该反应中有4 mol N—H键断裂,则生成的气体有______mol,其中转移电子数目______________。
(4)已知:C(s)+H2O(g)===CO(g)+H2(g)
ΔH1=+131.3 kJ·mol-1
C(s)+2H2O(g)===CO2(g)+2H2(g)
ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是_________________,
该反应的化学平衡常数K随温度的升高将________(填“增大”、“减小”或“不变”)。
(5)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液,实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,若水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计,求得该温度下CH3COOH的电离平衡常数K=1.7×10-5。向该溶液中再加入________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
(6) 现代化学传感器技术是研究溶液中离子反应的重要手段,某化学兴趣小组用1.0mol/LNaOH溶液滴定25mL未知浓度的盐酸溶液,并用电导率传感器测定过程中的电导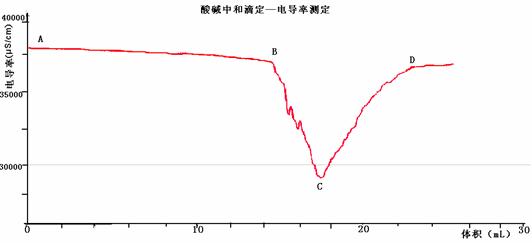 率,通过数据采集器自动记录测得的电导率并绘制电导率—V曲线,可显示滴定过程中的突跃现象(如图所示)。对于突跃现象最合理的解释是 。
率,通过数据采集器自动记录测得的电导率并绘制电导率—V曲线,可显示滴定过程中的突跃现象(如图所示)。对于突跃现象最合理的解释是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com