
27. (1
(1 4分)苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=
CH2)的反应方程式为:
4分)苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=
CH2)的反应方程式为:
C6H5-CH2CH3
(g) C6H5-CH=CH2
(g) +H2(g) ΔH1
C6H5-CH=CH2
(g) +H2(g) ΔH1
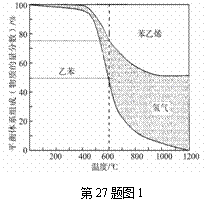
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状
态时,平衡体系组成(物质的量分数)与温度的关系如图1所示:
600℃时,由图1可知:
①氢气的物质的量分数为 。
②乙苯的平衡转化率为 。
③计算此温度下该反应的平衡常数 。
(2)分析上述平衡体系组成与温度的关系图可知:
①ΔH1 0(填“>”、“=”或“<”)。
②当温度高于970℃,苯乙烯的产率不再增加,其原因可能是 。
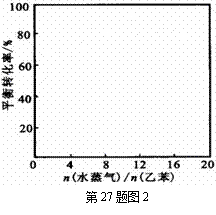 (3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的
平衡转化率为30%;在相同温度下,若反应体系中加入稀
释剂水蒸气并保持体系总压为101.3kPa,请在图2中画出
乙苯的平衡转化率与n(水蒸气)/n(乙苯)的关系曲线[n(水
蒸气)/n(乙苯)=12时,乙苯的平衡转化率基本保持不变]。
(4)已知:3C2H2
(g)  C6H6
(g) ΔH2
C6H6
(g) ΔH2
C6H6
(g) + C2H4
(g)  C6H5-CH2CH3
(g) ΔH3
C6H5-CH2CH3
(g) ΔH3
则反应3C2H2 (g) + C2H4 (g)  C6H5-CH=CH2
(g) +H2(g) 的ΔH= 。
C6H5-CH=CH2
(g) +H2(g) 的ΔH= 。
26.(14分)已知某物质A的相对分子质量为80,它是由三种元素组成的盐,其中X和氮元素的质量分数分别为50%和35%。另一元素Y的单质与足量的氧气在一定条件下反应生成标准状况下密度为1.964g·L-1的气体甲,X的最高价氧化物的水化物丁与甲反应生成白色沉淀乙和水。固体乙在高温下分解生成丙和气体甲。丁溶液的焰色反应的火焰呈砖红色。请回答下列问题:
(1)物质A的化学式为 ,甲的电子式为 。
(2)X的氢化物可作储氢材料, (填“可能”或“不可能”)与水发生反应产生H2,判断理由是 。
(3)物质A遇到水缓慢反应生成固体乙并放出刺激性气味的气体,该反应的化学方程式为 。为确认固体乙中是否混有酸式盐,请设计合理的实验方案进行验证: 。
(4)推测物质A可能的用途有 。
A.缓释性肥料 B.改良酸性土壤 C.生产炸药 D.补钙剂
13.某溶液中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等,将溶液分成4份,分别进行如下实验:
①酸化后滴加适量的淀粉KI溶液,呈蓝色
②滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出
③滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝
④加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色
下列说法不正确的是
A.根据实验④可推出溶液中不存在NO2-与SO32-
B.该溶液中一定含有NO3-、SO42-、NH4+
C.往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl-
D.根据实验①可推出溶液中含有NO3-或NO2-
12. 室温下,向20mL a mol·L-1CH3COOH溶液中逐滴加入0.1mol·L-1 NaOH溶液,其pH变化曲线如图所示。下列说法中,正确的是
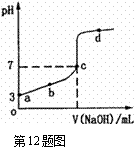 A.a=1×10-3
A.a=1×10-3
B.V(NaOH)=200amL时,溶液中:
c (Na+)= c(CH3COO-)+ c(CH3COOH)=0.1mol·L-1
C.该滴定实验使用甲基橙作指示剂
D.d点之后的溶液中离子浓度大小关系可能满足:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
11.利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
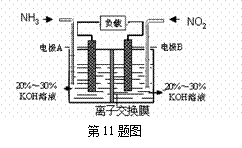 A.电流从右侧电极经过负载后流向左侧电极
A.电流从右侧电极经过负载后流向左侧电极
B.为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
10.下列说法正确的是
A.按系统命名法,化合物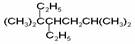 的名称是3,3,6-三甲基-4-乙基庚烷
的名称是3,3,6-三甲基-4-乙基庚烷
B.七叶内酯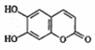 和东莨菪内酯
和东莨菪内酯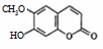 都是某些中草药中的成分,它们有相同的官能团,互为同系物
都是某些中草药中的成分,它们有相同的官能团,互为同系物
C.1mol有机物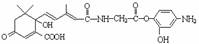 与NaOH溶液反应,最多消耗6mol NaOH
与NaOH溶液反应,最多消耗6mol NaOH
D.CH2=CH-CHO中滴加溴的四氯化碳溶液,溶液褪色,说明该物质中存在碳碳双键
9.五种短周期元素的某些性质如下表所示:
|
元素代号 |
X |
W |
Y |
Z |
Q |
|
原子半径(×10-12 m) |
37 |
99 |
66 |
104 |
154 |
|
主要化合价 |
+1 |
-1、+7 |
-2 |
-2、+6 |
+1 |
下列说法正确的是
A.由Q与Y形成的化合物中只存在离子键
B.Z与X之间形成的化合物具有还原性
C.X、Y元素组成的化合物的沸点高于X、Z元素组成化合物的沸点是由于Y非金属性比Z强
D.Y、Q、W三种元素组成化合物的水溶液一定显碱性
8.下列说法错误的是
A.H2O2在碱性溶液中、见光、遇热、遇到大多数金属氧化物分解加速
B.在实验室中吸入氯气、氯化氢气体时,可吸入少量酒精或乙醚的混合蒸气解毒
C.“阿司匹林的合成”实验抽滤制得乙酰水杨酸粗产品一步中,用冷水淋洗锥形瓶,直至所有晶体被收集到布氏漏斗中
D.取蛋白质溶液1mL于试管中,加入1mL10%的氢氧化钠溶液,再加入3-4滴1%的硫酸铜溶液,不断振荡,溶液呈现紫玫瑰色
7.下列说法错误的是
A.中国是目前全球最大的稀土生产国和出口国,对稀土元素及其化合物的研究是获得优良催化剂的一种重要途径
B.2013年11月22日,中科院国家纳米科学中心首次“拍”到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
C.用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素
D.使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺符合绿色化学的思想
19.下面是一个四肽,它可以看作是4个氨基酸缩合掉3个水分子而得:
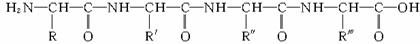
式中,R、R′、R″、R?可能是相同的或不同的烃基,或有取代 基的烃基。
基的烃基。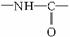 称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知它彻底水解后只得到下列四种氨基酸:
称为肽键。今有一个“多肽”,其分子式是C55H70O19N10,已知它彻底水解后只得到下列四种氨基酸:
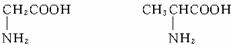
甘氨酸(C2H5NO2) 丙氨酸(C3H7NO2)
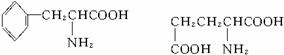
苯丙氨酸(C9H11NO2) 谷氨酸(C5H9NO4)
(1)该多肽是___________肽(填汉字)。
(2)该多肽水解后,得到___________个谷氨酸分子、___________个苯丙氨酸分子(填数字),其理由是(简要文字叙述或列出方程组均可)_________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com