
7.下列说法正确的是
A.糖类、油脂、蛋白质都是由C、H、O三种元素组成的高分子化合物
B.我们不需要从食物中摄取维生素,因为多数维生素能在人体内合成
C.由于缺碘会引起甲状腺肿大,所以我们要多食用加碘食盐
D.由于霉变食物中含有能损害人的肝脏、诱发肝癌等疾病的黄曲霉毒素,因此,我们绝对不能食用霉变食物
6.溶液是自然界中常见的物质。下列有关溶液的说法正确的是
A.溶液的上层浓度小,下层浓度大
B.溶液蒸干后,均能得到固体溶质
C.溶液中只有一种溶质时,溶液为纯净物
D.物质在溶解得到溶液的过程中,通常有放热或吸热的现象出现
5.下列说法正确的是
A.化石燃料主要包括煤、石油、天然气,属于可再生能源
B.可燃冰就是干冰 ,主要成分为CO2
,主要成分为CO2
C.乙醇是一种很好的燃料,属于不可再生能源
D.点燃氢气前一定要检验其纯度
4.下列有关的图示和图标中正确的是
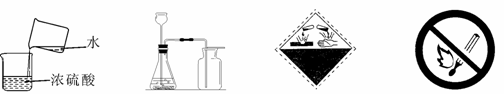
A.浓硫酸的稀释 B.实验室制取CO2 C.当心火灾 D.禁止吸烟
3.今年中国环境日(6月5日)的主题是“向污染宣战”。下列措施会引起环境污染的是
A.合理推广使用新能源 B.大量燃烧含硫燃料
C.控制家用汽车的使用 D.分类回收处理垃圾
2.下列过程发生了化学变化的是
A.水的沸腾 B.胆矾研碎 C.过滤液体 D.酸碱中和
一、选择题
1.下列物质不属于有机高分子材料的是
A.普通玻璃 B .合成纤维 C.天然橡胶 D.塑料薄膜
.合成纤维 C.天然橡胶 D.塑料薄膜
29.(14分) 阻垢剂可防止工业用水过程中无机物沉 积结垢的一类有机高分子物质,经由下列反应路线可得到E
积结垢的一类有机高分子物质,经由下列反应路线可得到E 和R两种阻垢剂(部分反应条件略去)。已知:烯醇不稳定,易异构为相应的醛,反应过程如下
和R两种阻垢剂(部分反应条件略去)。已知:烯醇不稳定,易异构为相应的醛,反应过程如下
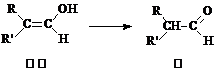
(1)阻垢剂E的制备。

D E
已知A可由一类重要的营养物质水解制得,A、B都 能与新制的Cu(OH)2反应,D能与NaHCO3溶液反应。
能与新制的Cu(OH)2反应,D能与NaHCO3溶液反应。
①A含有的官能团 。
②写出由B生成D的化学方程式 。
③D经加聚反应生成E,写出E的结 构简式 。
构简式 。
(2)阻垢剂R的制备:
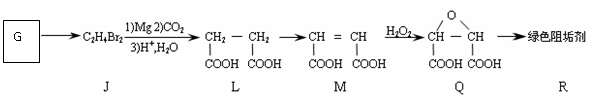
①G是A的同系物,写出G的结构简式 。
②写出由L制备M的合成路线(用化学方程式表示)。
①G是A的同一大类物质,是一种常见的抗冻剂。请写出G的结构简式 。
②写出由L制备M的合成路线(用化学方程式表示)。
HOOCCH2CH2COOH+Br2 HOOCCH2CHBrCOOH+HBr
HOOCCH2CHBrCOOH+HBr
(3)指出以上两种制备方法中符合“绿色化学”思想的过程(用代码表示)  。
。
(4)Q水化生成一种有机物Z,其核磁共振氢谱为1:1:1,写出Z的结构简式 。
(5)化合物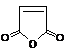 是合成某些药物的中间体。试设计合理方案由化合物
是合成某些药物的中间体。试设计合理方案由化合物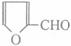 合成
合成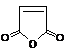 。
。
提示:①合成过程中无机试剂任选;
② 在 400℃有金属氧化物存在条件下能发生脱羰基(
在 400℃有金属氧化物存在条件下能发生脱羰基(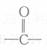 )反应。
)反应。
③合成反应流程图表示方法示例如下:

28.(14分)对氨基苯磺酸是制取染料和一些药物的重要中间体,可由苯胺磺化得到:
|
|
名称 |
性状 |
熔点/° C C |
沸点/°C |
在水中的溶解度(g/100mL) |
|
苯胺 |
无色油状液体 |
-6.1 |
184.4 |
3.6/18℃ |
|
对氨基苯磺酸 |
无色结晶 |
熔点365°C;内盐280~290°C |
0.8/10℃;1.08/20℃;6.67/100℃ |
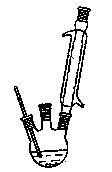
实验室中可用苯胺、浓硫酸为原料,利用右图实验装置模拟合成对氨基苯磺酸。实验步骤如下:
|
|
|
 ①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三
①在一个250 mL三颈烧瓶中加入10 mL苯胺及几粒沸石,将三 颈 烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。如右图所示,在三颈烧瓶的两个瓶口上分别装冷凝管、温度计(水银球浸入反应液中),另一个没有使用的瓶口用塞子塞紧。
颈 烧瓶放入冷水中冷却,小心地加入18 mL浓硫酸。如右图所示,在三颈烧瓶的两个瓶口上分别装冷凝管、温度计(水银球浸入反应液中),另一个没有使用的瓶口用塞子塞紧。
|
 ③将反应产物冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒
③将反应产物冷却至约50℃后,倒入盛有100 mL冷水的烧杯中,用玻璃棒
不断搅拌,促使对氨基苯磺酸晶体析出。用该烧杯中的少量冷水将烧瓶内
|
 苯磺酸粗产品。
苯磺酸粗产品。
④为提高产品的纯度,将粗产品通过一定实验操作得到产品。
请回答下列问题:
(1)装置中冷凝管的作用是 ,冷却水应从 口(填“a”或“b”)处通入,加入浓硫酸时烧瓶中出现白烟,杯壁上出现白色块状物,写出其反应方程式:
。
(2)步骤②中采用 加热,这种加热方法的优点 是 。
(3)步骤③用少量冷水洗涤晶体的好处是
 。
。
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先 ,然后 ,以防倒吸。
(5)步骤④中将粗产品先 ,再 ,抽滤,收集产品,晾干,以提高对氨基苯磺酸的纯度。每次抽滤后均应将母液收集起来,再进行适当处理,其目的是 。
27.(15分)铁及其化合物在工农业、生活中有广泛的应用。
Ⅰ、高铁酸钾(K 2FeO4)具有极强的氧化性,是一种优良的水处理剂。
2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作 用有
。
用有
。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ;发生反应的△H 0(填“>”、“<”或“=”)。
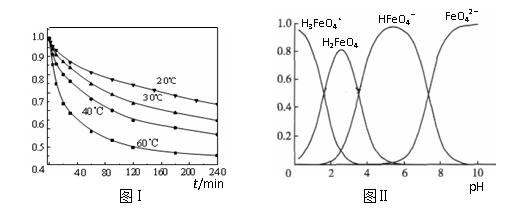
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
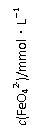

Ⅱ、氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:

(4)已知六水合氯化铁在水中的溶解度如下:
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(5)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(6)吸收剂X是: ;吸收塔中吸收剂X的作用是: 。
(7)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1Na2S2O3溶液滴定(I2+2S2O32—=2I- +S4O62-),共用去V mL。则样品中氯化铁的质量分数为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com