
6.苯的燃烧:
2C6H6+15O2点燃12CO2 + 6H2O
5.乙烯的加聚反应:
nCH2===CH2催化剂?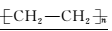
4.乙烯的加成反应:
Br2:CH2===CH2 + Br2―→CH2BrCH2Br
H2O:CH2===CH2+H2O催化剂加热、加压CH3CH2OH
H2:CH2===CH2+H2催化剂△CH3CH3
HCl:CH2===CH2+HCl―→CH3CH2Cl
3.乙烯的燃烧:
C2H4+3O2点燃2CO2+2H2O
2.甲烷与氯气反应生成CH3Cl:
CH4 + Cl2光 CH3Cl + HCl
一、重要的化学方程式
1.甲烷的燃烧:CH4+2O2点燃 CO2 + 2H2O
32.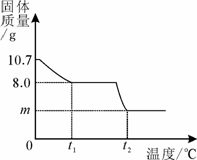 (6分)胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4·xH2O),华雪同学为研究CuSO4·xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4·xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4·xH2O
(6分)胆矾晶体部分失水后得到某硫酸铜晶体(CuSO4·xH2O),华雪同学为研究CuSO4·xH2O加热后所得物质的组成,做了以下实验:取10.7gCuSO4·xH2O晶体加热使其分解,绘制出固体的质量随温度的变化关系图。如图所示,到t1℃时该固体完全失去结晶水,化学方程式为:CuSO4·xH2O  CuSO4+ xH2O↑
CuSO4+ xH2O↑
(1)计算该硫酸铜晶体(CuSO4·xH2O)中x的值。
(CuSO4·x H2O的相对分子质量为:160+18x)
(2)CuSO4中铜元素的质量分数是多少?
(3)升温到t2℃,残留固体是黑色物质,则m= g。
(写出求m的过程)
五、计算题
31.(4分)人体胃酸过多会引起胃病。右图为某抗酸药包装标签上的部分文字,请回答下列问题。
(1)Al(OH)3的相对分子质量为 。
(2)经测定,每片该抗酸药实含氢氧化铝234mg。
计算一片该抗酸药可消耗7.3%的盐酸多少克(请写出计算过程)?
30.(12分)甲、乙两同学在学完酸的化学性质后,做了如下实验:
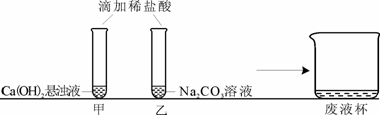
[观察与讨论1]甲同学在做实验时观察到的明显现象是 ① 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
[观察与讨论2]乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。所以甲同学认为,乙同学实验时还应 ② ,才能观察到有气泡产生。
[观察与讨论3]甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。经过讨论确定,甲同学的试管中废液含有的溶质一定有 ③ ,乙同学的试管中废液含有的溶质一定有 ④ (均写化学式)。
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
[提出问题]最终废液中含有什么溶质?
[猜想与假设]猜想1:废液中含有 ⑤ (写化学式)两种溶质。
猜想2:废液中含有 ⑥ (写化学式)三种溶质。
猜想3:废液中含有NaHCO3、CaCl2、 NaCl三种溶质。
[活动与探究]甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验: 取少量废液于试管中,向其中滴加盐酸,无气泡产生。
取少量废液于试管中,向其中滴加盐酸,无气泡产生。
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色。
[结论与反思](1)猜想 ⑦ (填“1”或“2” 或“3”)正确。
(2)要得到相同的结论,还可采用很多种方法。如加入氧化铁粉末,可观察到溶液呈 ⑧ 色,该反应的化学方程式为 ⑨ 。
[表达与交流]甲、乙同学确认了最终废液中溶质的成分,若直接排放,可能造成的危害是
⑩ ,你认为处理该废液的方法是 ⑪ 。
四、实验与探究题
29.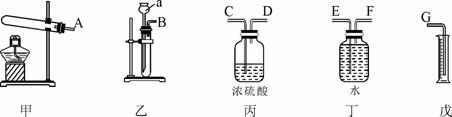 (6分)现有某黄铜(铜锌合金,假定其他成分均不与盐酸反应)样品,请从下图中选择适当的实验装置,设计最简单的实验测定该黄铜样品中锌的质量分数并回答下列问题:
(6分)现有某黄铜(铜锌合金,假定其他成分均不与盐酸反应)样品,请从下图中选择适当的实验装置,设计最简单的实验测定该黄铜样品中锌的质量分数并回答下列问题:
(1)写出仪器a的名称: 。
(2)实验要选择的装置是 (填装置编号)。若产生的气体从左向右流,则接口的顺序为 (填接口字母代号);
(3)细心观察发现:盛装溶液的试剂瓶与收集气体的集气瓶都有磨砂部分,所不同的是集气瓶的磨砂部分位于 。
a.瓶底内壁 b.瓶口边缘 c.瓶颈内壁 d.瓶底外壁
(4)仪器组装好后,在开始实验时,要先
 。
。
(5)若实验样品的质量是9.9g,实验中测定氢气的体积是1.1L(氢气密度为0.09g/L),则该黄铜样品中锌的质量分数为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com