
一、选择题
1.糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是 ( )
A. 牛油、纤维素和蛋白质都是天然高分子化合物
B. 淀粉水解的最终产物是葡萄糖 C. 葡萄糖能发生氧化反应和水解反应
D. 浓硫酸溅在皮肤上,使皮肤呈黄色是由于浓硫酸和蛋白质发生了颜色反应
21.(1)A池:2Cl- - 2e- == Cl2↑(1分)
B池:4OH––4e–== 2H2O + O2↑(1分)
⑵V(Cl2)= 224mL (2分); V(O2) = 112mL(2分)

三、计算题
21.如图所示的电解装置中,A池盛有200mL饱和KCl溶液,B池盛有200ml饱和CuSO4溶液,四个电极都用惰性材料制成,通电一段时间后,B池中阴极增重0.64g,求:
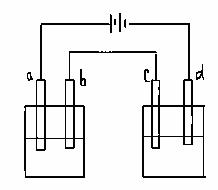
(1)写出A、B两池中阳极电极反应式
(2)计算标准状况下气体各为多少升?
 (2)5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑(3分)
(2)5H2C2O4+2MnO4-+6H+=2Mn2++8H2O+10CO2↑(3分)
(3) (其
(其 它合理表达式均给分)(4分)
它合理表达式均给分)(4分)
20.某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①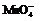 在酸性环境下的还原产物是
在酸性环境下的还原产物是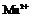 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
|
实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
 固体 固体 |
  溶液 溶液 |
褪色时间 |
|
1 |
65℃ |
— |
— |
1.0mL |
100s |
|
2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
|
3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
|
4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体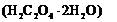 样品
样品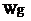 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
19.下表是元素周期表的一部分,请回答有关问题:
|
主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
|
|
|
① |
② |
|
③ |
|
|
3 |
|
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
④ |
|
|
|
|
⑩ |
|
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式
(3)④元素与⑦元素形成化合物的电子式
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是
(填化学式)。
(5)③元素与⑩元素 两者核电荷数之差是
。
两者核电荷数之差是
。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
|
实验步骤 |
实验现象与结论 |
 |
|
18.某化学课外小组为测定空气中CO2的含量,进行了如下实验:
①配制0.1000 mol/L 和0.01000 mol/L的标准盐酸。
②将2~3滴酚酞加入未知浓度的Ba(OH)2溶液10.00 mL中,并用0.1000 mol/L的标准盐酸进行滴定,结果用去盐酸19.60 mL。
③用测定的Ba(OH)2溶液吸收定量空气中的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里加水至刻度线,取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
④过滤上述所得浊液。
⑤取滤液20.00 mL,用0.01000 mol/L的盐酸滴定,用去盐酸34.80 mL。
请回答下列问题:
(1)配制标准盐酸时,需用下列哪些仪器? 。
A.托盘天平 B.容量瓶 C.酸式滴定管 D.量筒 E.烧杯 F.胶头滴管 G.玻璃棒
(2)②操作中到达滴定终点时的现象是 。
(3)Ba(OH)2溶液的物质的量浓度是________。
(4)此空气样品中含CO2的体积分数为________。
(5)本实验中,若第一次滴定时使用的酸式滴定管未经处理,即注入第二种标准盐酸,并进行第二次滴定,使测定结果________(填“偏大”“偏小”或“无影响”)。
二、实验题
17.由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。应用如下图所示电解实验可制得白色纯净的Fe(OH)2沉淀。两电 极的材料分别为石墨和铁。
极的材料分别为石墨和铁。
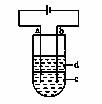
(1)a电极材料应为________________________________________,电极反应式为
_______________________________________________________;
(2)电解液c可以是(填编号)( )
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用为______________________________________________________,在加入苯之前对c应作怎样的简单处理?
______________________________ ________________。
________________。
(4)为了在较短时间内看到白色沉淀,可采取的措施(填编号)( )
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减少两电极间距离
D.适当降低电解液的温度
(5)若c为Na2SO4溶液,当电解一段时间看到白色Fe(OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为________________________________。
16.常温下,取0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合(不计混合后溶液体积变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是
A.混合溶液中由水电离出来的c(OH-)=1×10-9 mol/L
B.混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+)
C.c(OH-)-c(HY)=c(H+)=1 ×10-9 mol/L
×10-9 mol/L
D.c(Na+)=c(Y-)+c(HY)=0.3 mol/L
15.下列化学方程式或离子方程式,书写规范、正确的是(反应条件略)( )
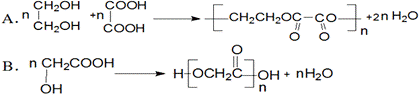

C.苯酚钠溶液中通入少量二氧化碳的离子方程式:

 +H2O+CO2
+H2O+CO2


 +HCO3—
+HCO3—
D.乙酸与碳酸钠溶液反应的离子方程式:2H+ + CO32— = CO2↑ + H2O
14.下列反应的离子方程式正确的是( )
A.用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
B.利用腐蚀法制作印刷线路板:Fe3+ + Cu = Fe2+ + Cu2+
C.次氯酸 钙溶液中通入过量二氧化硫:Ca2++2Cl0一+S02+H20=CaSO3↓+2HClO
钙溶液中通入过量二氧化硫:Ca2++2Cl0一+S02+H20=CaSO3↓+2HClO
D.等体积等物质的量浓 度的氢氧化钡溶液与碳酸氢铵溶液混合:
度的氢氧化钡溶液与碳酸氢铵溶液混合:
Ba2++20H-+NH4++HCO3-=BaC03↓+NH3·H2O+H20
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com