
16、下列分析不正确的是
A.
浊液a中存在沉淀溶解平衡: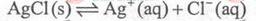
B. 滤液b中不含有Ag+
C. ③中颜色变化说明AgCI 转化为AgI
D. 实验可以证明AgI比AgCI更难溶
答案:B
解析:A、绝对不溶的物质没有,难溶物质在溶液中存在沉淀溶解平衡,故A正确;B、溶液中存在沉淀溶解平衡,滤液中含有Ag+,故B错误;C、D选项沉淀由白色变为黄色,说明生成AgI,反应向更难溶的方向进行,故CD正确。
15、(2013北京)实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCI溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
② 向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;
③ 向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。
14、(2013.福建)室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
A.与AlCl3溶液反应发生的离子方程式为 Al3++3OH—=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)、c(OH—)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
答案:C
解析:A中的氨水不能拆写;B项,加水稀释过程中,电离平衡常数不变,但溶液中c(NH3·H2O)减小,故c(NH4+)·c(OH-)减小,错;D不可能完全电离。
13、(双选)(2013海南)0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式不正确的是
A.c(H+)> c(F-) B.c(H+)> c(HF)
C.c(OH-)> c(HF) D.c(HF) > c(F-)
答案:BC
解析:电离后,因水也电离产生H+,所以c(H+)>c(F-)均约为0.01,c(HF)约0.09,c(OH-)为10-12。
12、(2013上海)H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-。若向H2S溶液中( )
H++S2-。若向H2S溶液中( )
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
答案:C
解析:加水,电离平衡虽向右移动,但因溶液体积变大,c(H+)减小,A项错误;通入少量SO2时,因发生SO2+2H2S=3S↓+2H2O,平衡向左移动,溶液pH增大、但通入过量SO2,最终溶液为饱和亚硫酸溶液,溶液pH减小,B项错误;加入新制氯水,发生反应:H2S+Cl2=S↓+2HCl,平衡向左移动,酸性增强,pH减小,C项正确;加入CuSO4后,发生反应:H2S+Cu2+=CuS↓+2H+,溶液中c(H+)变大,D项错误。
11、(2013大纲)右图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
A.两条曲线间任意点均有c(H+)×c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
答案:D
解析:随着温度的升高,Kw会增大,上面的曲线是浓度乘积较大的,所以C正确。只要是水溶液中,都会有A关系;B中,固定氢离子浓度为10-7,氢氧根浓度总是大于10-7。D 中是一条Kw渐渐变大的线,PH也变大。
10、25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL 0.01mol/L氨水中的Ksp比在20mL 0.01mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
答案:B
解析:Ksp[ Mg(OH)2]<Ksp(MgF2),故Mg(OH)2的溶解性比MgF2弱,饱和溶液中c(Mg2+)小,A错误;Mg(OH)2可溶于NH4Cl溶液,c(Mg2+)增大,B正确;Ksp只与温度有关,温度不变,Ksp不变,C错误;Mg(OH)2和MgF2的Ksp相差较小,故只要保持较大的c(F-),即可实现Mg(OH)2到MgF2的转化,D错误。
Mg(OH)2]<Ksp(MgF2),故Mg(OH)2的溶解性比MgF2弱,饱和溶液中c(Mg2+)小,A错误;Mg(OH)2可溶于NH4Cl溶液,c(Mg2+)增大,B正确;Ksp只与温度有关,温度不变,Ksp不变,C错误;Mg(OH)2和MgF2的Ksp相差较小,故只要保持较大的c(F-),即可实现Mg(OH)2到MgF2的转化,D错误。
9、下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
答案:B
解析:本题考查了沉淀溶解平衡的建立与特征。A项:反应开始时,各离子的浓度没有必然的关系。B项正确。C项沉淀溶解达到平衡时溶液中溶质的离子浓度保持不变,但不一定相等。D项:沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,由于固体的浓度为常数,故平衡不发生移动。
8、向蒸馏水中加入一定量的NaHSO3晶体,保持常温,测得溶液的pH=4,下列说法正确的是( )
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度:c(Na+)=c(HSO)+2c(SO)+c(H2SO3)
C.溶液中离子浓度:c(H+)+c(HSO)+2c(H2SO3)=c(OH-)
D.溶液中离子浓度: c(HSO)>c(SO)>c(H2SO3)
答案:D
解析:溶液中HSO3-会发生电离和水解反应:电离 HSO3- == H+
+ SO32- ①
水解 HSO3- + H2O
== H2SO3 + OH- ②
溶液的pH>4,说明①>②,即 电离占主导。
故溶液中H+的浓度是1×10-4mol/L,但是这么多H+ 是由HSO
电离占主导。
故溶液中H+的浓度是1×10-4mol/L,但是这么多H+ 是由HSO 3-电离产生的,而不是由水电离出的,A错。
溶液中由电荷守恒:[Na+]+[OH-]=[HSO3-]+2[SO32-]+[H+]④,④-③得到:[OH-]+[H2SO3]=[H+]+[SO32-],即质子守恒,所以B错。
3-电离产生的,而不是由水电离出的,A错。
溶液中由电荷守恒:[Na+]+[OH-]=[HSO3-]+2[SO32-]+[H+]④,④-③得到:[OH-]+[H2SO3]=[H+]+[SO32-],即质子守恒,所以B错。
由于NaHSO3中Na和S是1:1的关系,故由物料守恒有:[Na+]=[HSO3-]+[SO32-]+[H2SO3]③,C错。 由于电离程度大于水解程度,但是水解和电离只占HSO3-的一小部分,所以:[HSO3-]>[SO32-]>[H2SO3],D正确。
7、下列关于盐类水解的说法错误的是( )
A.在纯水中加入能水解的盐一定促进水的电离
B.同温时,等浓度的NaHCO3和Na2CO3溶液,NaHC O3溶液的pH大
O3溶液的pH大
C.在NH4Cl溶液中加入稀HNO3能抑制NH水解
D.加热CH3COONa溶液,溶液中的值将减小
答案:B
解析:盐类水解促进水的电离,A对;同温下,同等浓度的Na2CO3中CO水解程度大于HCO,所以Na2CO3溶液的碱性大,B错;NH水解使溶液显酸性,加入HNO3抑制NH水解,C对;加热CH3COONa溶液,CH3COO-水解程度增大,c(CH3COO-)减小,c(Na+)不变,则变小,D对。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com