
二、烃的衍生物
1、乙醇和乙酸的性质比较
|
有机物 |
饱和一元醇 |
饱和一元醛 |
饱和一元羧酸 |
|
通式 |
CnH2n+1OH |
—— |
CnH2n+1COOH |
|
代表物 |
乙醇 |
乙醛 |
乙酸 |
|
结构简式 |
CH3CH2OH 或 C2H5OH |
CH3CHO |
CH3COOH |
|
官能团 |
羟基:-OH |
醛基:-CHO |
羧基:-COOH |
|
物理性质 |
无色、有特殊香味的液体,俗名酒精,与水互溶,易挥发 (非电解质) |
—— |
有强烈刺激性气味的无色液体,俗称醋酸,易溶于水和乙醇,无水醋酸又称冰醋酸。 |
|
用途 |
作燃料、饮料、化工原料;用于医疗消毒,乙醇溶液的质量分数为75% |
—— |
有机化工原料,可制得醋酸纤维、合成纤维、香料、燃料等,是食醋的主要成分 |
|
有机物 |
主 要 化 学 性 质 |
|
乙醇 |
①与Na的反应 2CH3CH2OH+2Na—→2CH3CH2ONa+H2↑ 乙醇与Na的反应(与水比较):①相同点:都生成氢气,反应都放热 ②不同点:比钠与水的反应要缓慢 结论:乙醇分子羟基中的氢原子比烷烃分子中的氢原子活泼,但没有水分子中的氢原子活泼。 ②氧化反应 (ⅰ)燃烧 CH3CH2OH+3O2—→2CO2+3H2O (ⅱ)在铜或银催化条件下:可以被O2氧化成乙醛(CH3CHO) 2CH3CH2OH+O2 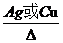 →2CH3CHO+2H2O →2CH3CHO+2H2O③消去反应 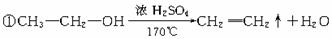 |
|
乙醛 |
氧化反应:醛基(-CHO)的性质-与银氨溶液,新制Cu(OH)2反应 CH3CHO+2Ag(NH3)2OH——→CH3COONH4+H2O +2Ag↓+3NH3↑ (银氨溶液) CH3CHO + 2Cu(OH)2——→CH3COOH+Cu2O↓+2H2O (砖红色) 醛基的检验:方法1:加银氨溶液水浴加热有银镜生成。 方法2:加新制的Cu(OH)2碱性悬浊液加热至沸有砖红色沉淀 |
|
乙酸 |
①具有酸的通性:弱酸,不完全电离:CH3COOH≒CH3COO-+H+ 使紫色石蕊试液变红;  与活泼金属,碱,弱酸盐反应,如CaCO3、Na2CO3 与活泼金属,碱,弱酸盐反应,如CaCO3、Na2CO3酸性比较:CH3COOH > H2CO3 2CH3COOH+CaCO3=2(CH3COO)2Ca+CO2↑+H2O(强制弱) ②酯化反应 CH3COOH+C2H5OH → CH3COOC2H5+H2O 酸脱羟基 醇脱氢 |
7、比较同类烃的沸点:
①一看:碳原子数多沸点高。
②碳原子数相同,二看:支链多沸点低。
常温下,碳原子数1-4的烃都为气体。
6、烷烃的命名:
(1)普通命名法:把烷烃泛称为“某烷”,某是指烷烃中碳原子的数目。1-10用甲,乙,丙,丁,戊,已,庚,辛,壬,癸;11起汉文数字表示。区别同分异构体,用“正”,“异”,“新”。
正丁烷,异丁烷;正戊烷,异戊烷,新戊烷。
(2)系统命名法:
①命名步骤:(1)找主链-最长的碳链(确定母体名称);(2)编号-靠近支链(小、多)的一端;
(3)写名称-先简后繁,相同基请合并.
②名称组成:取代基位置-取代基名称母体名称
③阿拉伯数字表示取代基位置,汉字数字表示相同取代基的个数
CH3-CH-CH2-CH3 CH3-CH-CH-CH3
2-甲基丁烷 2,3-二甲基丁烷
4、同系物、同分异构体、同素异形体、同位素比较。
|
概念 |
同系物 |
同分异构体 |
同素异形体 |
同位素 |
|
定义 |
结构相似,在分子组成上相差一个或若干个CH2原子团的物质 |
分子式相同而结构式不同的化合物的互称 |
由同种元素组成的不同单质的互称 |
质子数相同而中子数不同的同一元素的不同原子的互称 |
|
分子式 |
不同 |
相同 |
元素符号表示相同,分子式可不同 |
—— |
|
结构 |
相似 |
不同 |
不同 |
—— |
|
研究对象 |
化合物 |
化合物 |
单质 |
原子 |
3、甲烷、乙烯和苯的性质比较:
|
有机物 |
烷烃 |
烯烃 |
苯及其同系物 |
|
通式 |
CnH2n+2 |
CnH2n |
—— |
|
代表物 |
甲烷(CH4) |
乙烯(C2H4) |
苯(C6H6) |
|
结构简式 |
CH4 |
CH2=CH2 |
  或 或 |
|
(官能团) 结构特点 |
C-C单键, 链状,饱和烃 |
C=C双键, 链状,不饱和烃 |
一种介于单键和双键之间的独特的键,环状 |
|
空间结构 |
正四面体 |
六原子共平面 |
平面正六边形 |
|
物理性质 |
无色无味的气体,比空气轻,难溶于水 |
无色稍有气味的气体,比空气略轻,难溶于水 |
无色有特殊气味的液体,比水轻,难溶于水 |
|
用途 |
优良燃料,化工原料 |
石化工业原料,植物生长调节剂,催熟剂 |
溶剂,化工原料 |
|
有机物 |
主 要 化 学 性 质 |
|
烷烃: 甲烷 |
①氧化反应(燃烧) CH4+2O2——→CO2+2H2O(淡蓝色火焰,无黑烟) ②取代反应 (注意光是反应发生的主要原因,产物有5种) CH4+Cl2—→CH3Cl+HCl CH3Cl +Cl2—→CH2Cl2+HCl CH2Cl2+Cl2—→CHCl3+HCl CHCl3+Cl2—→CCl4+HCl 在光照条件下甲烷还可以跟溴蒸气发生取代反应, 甲烷不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。 |
|
烯烃: 乙烯 |
①氧化反应 (ⅰ)燃烧
C2H4+3O2——→2CO2+2H2O(火焰明亮,有黑烟) (ⅱ)被酸性KMnO4溶液氧化,能使酸性KMnO4溶液褪色。 ②加成反应 CH2=CH2+Br2-→CH2Br-CH2Br(能使溴水或溴的四氯化碳溶液褪色) 在一定条件下,乙烯还可以与H2、Cl2、HCl、H2O等发生加成反应 CH2=CH2+H2——→CH3CH3 CH2=CH2+HCl-→CH3CH2Cl(氯乙烷) CH2=CH2+H2O——→CH3CH2OH(制乙醇) ③加聚反应 nCH2=CH2——→-CH2-CH2-n(聚乙烯) 乙烯能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。常利用该反应鉴别烷烃和烯烃,如鉴别甲烷和乙烯。 |
|
苯 |
①氧化反应(燃烧)
2C6H6+15O2—→12CO2+6H2O(火焰明亮,有浓烟) ②取代反应  苯环上的氢原子被溴原子、硝基取代。 苯环上的氢原子被溴原子、硝基取代。  +Br2——→ —Br +HBr +Br2——→ —Br +HBr  +HNO3——→ —NO2 +H2O +HNO3——→ —NO2 +H2O③加成反应   +3H2 +3H2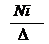 → →苯不能使酸性KMnO4溶液、溴水或溴的四氯化碳溶液褪色。 |
2、烃的分类:
 饱和烃→烷烃(如:甲烷)
饱和烃→烷烃(如:甲烷)
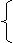 脂肪烃(链状)
脂肪烃(链状)
烃 不饱和烃→烯烃(如:乙烯)
芳香烃(含有苯环)(如:苯)
一、烃
1、烃的定义:仅含碳和氢两种元素的有机物称为碳氢化合物,也称为烃。
2、化学反应的限度——化学平衡
(1)在一定条件下,当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度,即化学平衡状态。
化学平衡的移动受到温度、反应物浓度、压强等因素的影响。催化剂只改变化学反应速率,对化学平衡无影响。
在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应。通常把由反应物向生成物进行的反应叫做正反应。而由生成物向反应物进行的反应叫做逆反应。
在任何可逆反应中,正方应进行的同时,逆反应也在进行。可逆反应不能进行到底,即是说可逆反应无论进行到何种程度,任何物质(反应物和生成物)的物质的量都不可能为0。
(2)化学平衡状态的特征:逆、动、等、定、变。
①逆:化学平衡研究的对象是可逆反应。
②动:动态平衡,达到平衡状态时,正逆反应仍在不断进行。
③等:达到平衡状态时,正方应速率和逆反应速率相等,但不等于0。即v正=v逆≠0。
④定:达到平衡状态时,各组分的浓度保持不变,各组成成分的含量保持一定。
⑤变:当条件变化时,原平衡被破坏,在新的条件下会重新建立新的平衡。
(3)判断化学平衡状态的标志:
① VA(正方向)=VA(逆方向)或nA(消耗)=nA(生成)(不同方向同一物质比较)
②各组分浓度保持不变或百分含量不变
③借助颜色不变判断(有一种物质是有颜色的)
④总物质的量或总体积或总压强或平均相对分子质量不变(前提:反应前后气体的总物质的量不相等的反应适用,即如对于反应xA+yB zC,x+y≠z )
zC,x+y≠z )
第三章 有机化合物
绝大多数含碳的化合物称为有机化合物,简称有机物。像CO、CO2、碳酸、碳酸盐等少数化合物,由于它们的组成和性质跟无机化合物相似,因而一向把它们作为无机化合物。
1、化学反应的速率
(1)概念:化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。 计算公式:v(B)=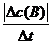 =
=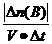
①单位:mol/(L·s)或mol/(L·min)
②B为溶液或气体,若B为固体或纯液体不计算速率。
③以上所表示的是平均速率,而不是瞬时速率。
④重要规律:(i)速率比=方程式系数比 (ii)变化量比=方程式系数比
(2)影响化学反应速率的因素:
内因:由参加反应的物质的结构和性质决定的(主要因素)。
外因:①温度:升高温度,增大速率
②催化剂:一般加快反应速率(正催化剂)
③浓度:增加C反应物的浓度,增大速率(溶液或气体才有浓度可言)
④压强:增大压强,增大速率(适用于有气体参加的反应)
⑤其它因素:如光(射线)、固体的表面积(颗粒大小)、反应物的状态(溶剂)、原电池等也会改变化学反应速率。
2、化学电源基本类型:
①干电池:活泼金属作负极,被腐蚀或消耗。如:Cu-Zn原电池、锌锰电池。
②充电电池:两极都参加反应的原电池,可充电循环使用。如铅蓄电池、锂电池和银锌电池等。
③燃料电池:两电极材料均为惰性电极,电极本身不发生反应,而是由引入到两极上的物质发生反应,如H2、CH4燃料电池,其电解质溶液常为碱性试剂(KOH等)。
第三节 化学反应的速率和限度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com