
4、海带提碘
海带中的碘元素主要以I-的形式存在,提取时用适当的氧化剂将其氧化成I2,再萃取出来。证明海带中含有碘,
实验方法:(1)用剪刀剪碎海带,用酒精湿润,放入坩锅中。
(2)灼烧海带至完全生成灰,停止加热,冷却。
(3)将海带灰移到小烧杯中,加蒸馏水,搅拌、煮沸、过滤。
(4)在滤液中滴加稀H2SO4及H2O2然后加入几滴淀粉溶液。
证明含碘的现象:滴入淀粉溶液,溶液变蓝色。2I-+H2O2+2H+=I2+2H2O
第二节 化学与资源综合利用、环境保护
3、海水提溴
浓缩海水 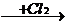 溴单质
溴单质 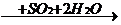 氢溴酸
氢溴酸 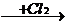 溴单质
溴单质
有关反应方程式:①2NaBr+Cl2=Br2+2NaCl ②Br2+SO2+2H2O=2HBr+H2SO4
③2HBr+Cl2=2HCl+Br2
2、海水淡化的方法:蒸馏法、电渗析法、离子交换法等。其中蒸馏法的历史最久,蒸馏法的原理是把水加热到水的沸点,液态水变为水蒸气与海水中的盐分离,水蒸气冷凝得淡水。
二、海水资源的开发利用
1、海水是一个远未开发的巨大化学资源宝库
海水中含有80多种元素,其中Cl、Na、K、Mg、Ca、S、C、F、B、Br、Sr 11种元素的含量较高,其余为微量元素。常从海水中提取食盐,并在传统海水制盐工业基础上制取镁、钾、溴及其化合物。
5、 (1)回收金属的意义:节约矿物资源,节约能源,减少环境污染。(2)废旧金属的最好处理方法是回收利用。(3)回收金属的实例:废旧钢铁用于炼钢;废铁屑用于制铁盐;从电影业、照相业、科研单位和医院X光室回收的定影液中,可以提取金属银。
|
金属的活动性顺序 |
K、Ca、Na、 Mg、Al |
Zn、Fe、Sn、 Pb、(H)、Cu |
Hg、Ag |
Pt、Au |
|
金属原子失电子能力 |
 强
弱 强
弱 |
|||
|
金属离子得电子能力 |
 弱
强 弱
强 |
|||
|
主要冶炼方法 |
电解法 |
热还原法 |
热分解法 |
富集法 |
|
还原剂或 特殊措施 |
强大电流 提供电子 |
H2、CO、C、 Al等加热 |
加热 |
物理方法或 化学方法 |
4、金属冶炼的方法
(1)电解法:适用于一些非常活泼的金属。
2NaCl(熔融) 2Na+Cl2↑ MgCl2(熔融)
2Na+Cl2↑ MgCl2(熔融) Mg+Cl2↑ 2Al2O3(熔融)
Mg+Cl2↑ 2Al2O3(熔融) 4Al+3O2↑
4Al+3O2↑
(2)热还原法:适用于较活泼金属。
Fe2O3+3CO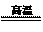 2Fe+3CO2↑ WO3+3H2
2Fe+3CO2↑ WO3+3H2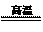 W+3H2O
ZnO+C
W+3H2O
ZnO+C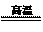 Zn+CO↑
Zn+CO↑
常用的还原剂:焦炭、CO、H2等。一些活泼的金属也可作还原剂,如Al,
Fe2O3+2Al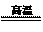 2Fe+Al2O3(铝热反应) Cr2O3+2Al
2Fe+Al2O3(铝热反应) Cr2O3+2Al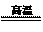 2Cr+Al2O3(铝热反应)
2Cr+Al2O3(铝热反应)
(3)热分解法:适用于一些不活泼的金属。
2HgO 2Hg+O2↑
2Ag2O
2Hg+O2↑
2Ag2O 4Ag+O2↑
4Ag+O2↑
3、金属冶炼的一般步骤: (1)矿石的富集:除去杂质,提高矿石中有用成分的含量。(2)冶炼:利用氧化还原反应原理,在一定条件下,用还原剂把金属从其矿石中还原出来,得到金属单质(粗)。(3)精炼:采用一定的方法,提炼纯金属。
2、 金属冶炼的涵义:简单地说,金属的冶炼就是把金属从矿石中提炼出来。金属冶炼的实质是把金属元素从化合态还原为游离态,即M(化合态)
M(游离态)。
金属冶炼的涵义:简单地说,金属的冶炼就是把金属从矿石中提炼出来。金属冶炼的实质是把金属元素从化合态还原为游离态,即M(化合态)
M(游离态)。
一、金属矿物的开发利用
1、金属的存在:除了金、铂等少数金属外,绝大多数金属以化合态的形式存在于自然界。
三、基本营养物质
食物中的营养物质包括:糖类、油脂、蛋白质、维生素、无机盐和水。人们习惯称糖类、油脂、蛋白质为动物性和植物性食物中的基本营养物质。
|
种类 |
元 |
代表物 |
代表物分子 |
|
||
|
糖类 |
单糖 |
C H O |
葡萄糖 |
C6H12O6 |
葡萄糖和果糖互为同分异构体 单糖不能发生水解反应 |
|
|
果糖 |
||||||
|
双糖 |
C H O |
蔗糖 |
C12H22O11 |
蔗糖和麦芽糖互为同分异构体 能发生水解反应 |
||
|
麦芽糖 |
||||||
|
多糖 |
C H O |
淀粉 |
(C6H10O5)n |
淀粉、纤维素由于n值不同,所以分子式不同,不能互称同分异构体 能发生水解反应 |
||
|
纤维素 |
||||||
|
油脂 |
油 |
C H O |
植物油 |
不饱和高级脂肪酸甘油酯 |
含有C=C键,能发生加成反应, 能发生水解反应 |
|
|
脂 |
C H O |
动物脂肪 |
饱和高级脂肪酸甘油酯 |
C-C键, 能发生水解反应 |
||
|
蛋白质 |
C H O N S P等 |
酶、肌肉、毛发等 |
氨基酸连接成的高分子 |
能发生水解反应 |
||
|
|
主 要 化 学 性 质 |
|||||
|
葡萄糖 |
结构简式:CH2OH-CHOH-CHOH-CHOH-CHOH-CHO 或CH2OH(CHOH)4CHO (含有羟基和醛基) 醛基:①使新制的Cu(OH)2产生砖红色沉淀-测定糖尿病患者病情 ②与银氨溶液反应产生银镜-工业制镜和玻璃瓶瓶胆 羟基:与羧酸发生酯化反应生成酯 |
|||||
|
蔗糖 |
水解反应:生成葡萄糖和果糖 |
|||||
|
淀粉 纤维素 |
淀粉、纤维素水解反应:生成葡萄糖 淀粉特性:淀粉遇碘单质变蓝 |
|||||
|
油脂 |
水解反应:生成高级脂肪酸(或高级脂肪酸盐)和甘油 |
|||||
|
蛋白质 |
水解反应:最终产物为氨基酸 颜色反应:蛋白质遇浓HNO3变黄(鉴别部分蛋白质) 灼烧蛋白质有烧焦羽毛的味道(鉴别蛋白质) |
|||||
第四章 化学与可持续发展
第一节 开发利用金属矿物和海水资源
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com