
22.(9分) 水是一种宝贵的自然资源。
(1)生活污水中,常含N、P化合物而造成水体植物富营养化污染。水中的氨在微生物的作用下,可发生以下一系列变化:A、 NH3 + O2 →HNO2+ H2O(未配平)
B、2HNO2+O2 → 2HNO3,回答以下问题
① 配平反应A并标出电子转移的方向与数目:
____NH3+ ___O2 → ___HNO2+ ____ H2O
② 反应B中被氧化的元素是 。
(2)氧化还原法是处理污水常用的方法之一。某工厂排放的污水,经检测,污水中含有
二、
21.(7分)下表是元素周期表的一部分,针对表中元素,填写下列空白。
|
族 周期 |
ⅠA |
|
0 |
|||||
|
1 |
|
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
① |
② |
③ |
④ |
|
|
3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
⑾ |
|
(1)⑦的阳离子结构示意图为______________。
(2)元素①和③形成的AB2型化合物中存在的化学键是________,该物质的电子式为_____。
(3)上述①~⑾元素中,金属性最强的元素是 (填元素符号),原子半径最小的元素是_____。(填元素符号)
(4)元素④ ⑩ ⑾的氢化物中稳定性最弱的是 (填化学式)。②⑧⑨的最高价氧化物对应水化物中酸性最强的是 。(填化学式)
20、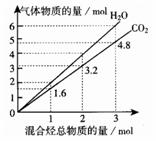 两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如右图所示。下列有关混合气体的说法错误的是
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如右图所示。下列有关混合气体的说法错误的是
A、该混合气体一定含有甲烷
B、该混合气体中一定含有乙烯
C、在110℃条件下,该混合气体与氧气混合,总混合气燃烧前后体积不变
D、若混合气体由CH4和C2H4组成,则其体积比为2∶3
19、设NA为阿伏加德罗常数,下列叙述中正确的是
A.、常温下,11.2LO2气体含有O2分子数为0.5NA
B、14 g 乙烯和丙烯的混合物中总原子数为3NA
C、0.1 mol/L 的NaOH溶液含钠离子数为0.1NA
D、5.6 g铁与足量稀硫酸反应失去电子数为0.3NA
18、叠氮酸(HN3)与醋酸酸性相似,下列叙述中正确的是
A、HN3水溶液中微粒浓度大小顺序为:C(HN3)> C(H+)> C(N3¯)> C(OH¯)
B、HN3水溶液中微粒浓度大小顺序为:C(H+)> C(HN3)> C(N3¯)> C(OH¯)
C、NaN3水溶液中离子浓度大小顺序为:C(Na+)> C(N3¯)> C(H+)> C(OH¯)
D、HN3与NH3作用生成的产物是共价化合物
17、下列实验装置能达到实验目的是
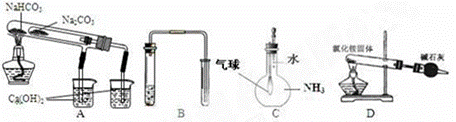
A、比较碳酸钠和碳酸氢钠热稳定性大小
B、用铜和稀硝酸制取并收集少量NO
C、验证氨气在水中溶解性
D、实验室用氯化铵制氨气
16、下列关于实验的误差分析错误的是
A、配制NaOH溶液时,用称量纸称取NaOH,所得溶液浓度偏低
B、用标准盐酸滴定未知浓度的NaOH溶液时,锥形瓶用NaOH溶液润洗,所得结果偏高 C、测定硫酸铜晶体中结晶水含量的过程中,不小心加热至固体呈微黑,所得结果偏高
D、测量气体摩尔体积时,镁条表面没有处理,所得结果偏高
15、在A、B、C三试管中分别盛有Cl- 、Br-、I- 的溶液,向A试管中加入新制的氯水和CCl4 ,出现分层,下层为橙红色,再将此溶液倒入C试管中,无变化,则A、B、C三支试管中所盛有的离子依次是
A、I-、Br-、Cl- B、 Br-、 I- 、Cl- C、 Cl- 、I-、Br- D、 Br-、Cl- 、I-
14、配置0.5mol/L的碳酸钠溶液250ml时,下列仪器不需要的是
 A A |
 B B |
 C C |
D  |
13、PH=1的无色溶液中,下列离子能大量共存的是
A、Al3+ 、Na+ 、NO3— B、Cu2+ 、Na+ 、Cl—
C、 Ba2+ 、K+、 CO32- D、CH3COO—、OH—、NH4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com