
23.(共8分)(1)C (2)0.024mol/(L•min)(3)增大、增大、减小 (4)BD
22、(共9分)(1)①2NH3+3O2 → 2HNO2+2H2O (2+1+1分)② +3价N (1分)
(2) SO32-+Br2 → SO42- +2Br- (2分) 1.2 L (2分)
一、每题只有一个正确选项
21、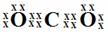 (共7分)(1) (2) 共价键或极性键、
(共7分)(1) (2) 共价键或极性键、
(3) Na、F (4) H2S、HNO3
五、
28.空调中铝质蒸发器和冷凝器易氧化,影响空调器的寿命。铜-铝合金蒸发器和冷凝器的成 功开发解决了制冷行业
功开发解决了制冷行业 的一大难题,被称为二十一世纪制冷行业革命性的创新。
的一大难题,被称为二十一世纪制冷行业革命性的创新。
(1)为测定该铜-铝合金的质量分数,将5.6克合金样品粉碎,投入到足量盐酸中,充分反应后得到气体6.72L(标准状况)。此铜 -铝合金中铝的质量分数为 (精确到0.01)。
-铝合金中铝的质量分数为 (精确到0.01)。
(2)将上述反应液过滤,并将滤液稀释到100mL(写出简要计算过程)
①稀释后,溶液中Al3+的物质的量浓度为多少?
②从上述滤液中取出10mL,要想获得0.78克沉淀,至少加入0.5 mol/L NaOH溶液的体积为多少mL?
高二学业水平模拟卷
答案及评分
20140530
27.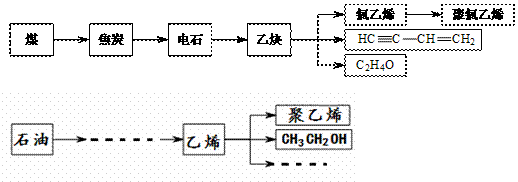 (8分)煤和石油是一个国家化工发展的支柱,煤和石油产品是合成橡胶、纤维、树脂等的基本原料,如煤产品乙炔、石油产品乙烯是化工基本原料之一。根据下列流程,完成以下问题。
(8分)煤和石油是一个国家化工发展的支柱,煤和石油产品是合成橡胶、纤维、树脂等的基本原料,如煤产品乙炔、石油产品乙烯是化工基本原料之一。根据下列流程,完成以下问题。
(1)写出电石制取乙炔的化学方程式________________________________。
(2)随意丢弃聚氯乙烯制品会造成白色污染,聚氯乙烯的结构简式为_________________。
C2H4O中是否含有醛基可用_________________________(填试剂名称)来检验。
(3)有机物CH3CH2OH的俗称 ,含有的官能团名称是 。
(4)由乙炔制备聚氯乙烯、由乙烯制备聚乙烯的过程中均涉及到的化学反应类型是( )
A 氧化反应 B 取代反应 C 加聚反应 D 消去反应
(5)石油经一系列加工过程获得乙烯,其中不涉及到的物质分离方法是( )
A、分馏 B、过滤 C、干馏 D、裂解
四、
26.科学家致力于二氧化碳的“组合转化”技术的研究,把过多二氧化碳转化为有益于人类的物质。
(1)如果将CO2和H2以1:4的比例混合,通入反应器,在适当的条件下反应,可获得一种重要的能源,请完成以下化学方程式:CO2 + 4H2 → + 2H2O
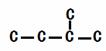
(2)二氧化碳“组合转化”的某烷烃碳架结构如图所示:
此烷烃的一溴代物有 种。若此烷烃为炔烃加氢制得,则此炔烃的结构简式为: ___
25.(8分)根据实验室中测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验,填写下列空白:⑴ 从下列仪器中选出所需仪器(用标号字母填写)_____________________。
A.电子天平 B.试管夹 C.烧杯
D.蒸发皿 E.坩埚 F.石棉网
除上述仪器和酒精灯外,还需要的仪器是____________,________________(任意填写两种)。
⑵ 某学生实验后得到以下数据:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水硫酸铜) |
|
5.400 g |
7.900 g |
7.100 g |
①根据以上数据计算该硫酸铜晶体中结晶水x的值为_____________(精确到0.1)。
②若另一学生经实验测得x= 4.9,该学生实验结果产生误差的原因可能是(填写字母)________。
A.没有进行恒重操作 B.加热后在干燥器中冷却至室温后称量
C.加热固体到白色后,露置在空气中冷却 D.加热过程中晶体有少量溅失
三、
24.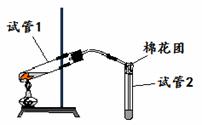 (7分)如图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
(7分)如图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图.往试管1中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管2的溶液中.回答以下问题:
(1)写出用铜片与浓硫酸制取SO2的化学方程式:
(2)若试管2中的溶液是品红试液,反应一段时间后,看到的现象是 ,
反应充分后,取下试管2并在酒精灯上加热,看到的现象是 。
若试管2中的溶液是KMnO4溶液,反应一段时间后,看到的现象是 ,说明了SO2具有 性。
(3)实验过程中,试管2管口塞一团浸有NaOH溶液的棉花,作用是
23.(8分)工业上合成氨的反应原理如下:N2(g)+3H2(g) 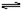 2NH3(g) +Q(Q>0)。
2NH3(g) +Q(Q>0)。
在一密闭容器中进行合成氨反应,一段时间后达到平衡。回答下列问题:
(1)要使H2得到充分利用,可采用的措施是____________;
a.加入氢气 b.升温 c.加压 d.加催化剂
(2)450℃时,往2L密闭容器中充入1 mol N2和2.6 mol H2,反应过程中NH3的物质的量浓度随时间的变化情况如下表所示:
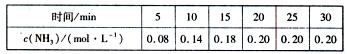
反应开始的5 min内,用消耗氢气表示反应的平均反应速率为 ;
(3)升高温度,v(正)______(填增大、减小或不变),v(逆) ______(填增大、减小或不变),反应混合物中氨气的体积分数________(填增大、减小或不变);
(4)下列叙述中,能说明该合成氨反应已达到平衡的是 (填字母代号)。
A.容器内的气体密度保持不变
B.容器内的气体压强保持不变
C.容器内N2、H2、NH3物质的量浓度之比为1:3:2
D.单位时间内消耗a mol N2,同时生成3a mol H2
0.012 mol/L的游离态溴,可用Na2SO3还原除去污水中的溴,请写出其离子方程式:
若处理5L这种污水,至少需加入0.05mol/L的Na2SO3溶液 L才能将单质溴全部除去。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com