
5.工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考虑最合理的反应是( )。
A.C3H8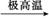 3C+4H2
3C+4H2
B.C3H8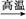 C3H6+H2
C3H6+H2
C.C3H8+6H2O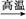 3CO2+10H2
3CO2+10H2
D.2H2O 2H2↑+O2↑
2H2↑+O2↑
解析:C3H8+6H2O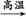 3CO2+10H2这一反应最合理,不仅产生的H2量多,而且耗能还少,选C项。
3CO2+10H2这一反应最合理,不仅产生的H2量多,而且耗能还少,选C项。
答案:C
4.下列关于石油、煤、天然气的说法正确的是( )。
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.水煤气是通过煤的液化得到的气体燃料
D.天然气是一种清洁的化石燃料
解析:石油裂解后得到的 是混合物,A项错误;只有石油产品中那些不饱和烃才能发生聚合反应,B项错误;水煤气是高温下碳与水蒸气反应后的产物,C项错误;故选D。
是混合物,A项错误;只有石油产品中那些不饱和烃才能发生聚合反应,B项错误;水煤气是高温下碳与水蒸气反应后的产物,C项错误;故选D。
答案:D
3.下列金属的冶炼不适宜用热还原法来冶炼的是( )。
A.铁 B.铜 C.钠 D.铅
解析:钠属于非常活泼的金属,可使用电解法冶炼;铜、铁、铅属于较活泼金属,使用热还原法冶炼。
答案:C
2.下列做法能改善空气质量的是( )。
A.以煤等燃料作为主要生活燃料
B.利用太阳能、风能和氢能 等能源代替化石能源
等能源代替化石能源
C.鼓励私人购买和使用汽车代替公交车
D.限制使用电动车
解析:空气污染主要是化石燃料燃烧造成的,改善环境最好的方法就是减少化石能源的使用。
答案:B
一、选择题
1.能源问题是当今世界发展的一个主要问题。下列能源符合“绿色化学”的概念的是( )。
A.氢气 B.煤 C.沼气 D.石油
解析:“绿色化学”即无污染化学,选A项。
答案:A
21.(10分)现有一种有机物A,分子式为C4H6O6。对于A的结构与性质实验结论如下:
 i:A的分子中有两个羧基;
i:A的分子中有两个羧基;
ii:A的核磁共振氢谱如右图所示;
右图是利用烃B和烃I合成有机物A和一种高分子新材料R的转化关系示意图,已知烃I的相对分子质量为28,且F的相对分子质量比E多28。


已知:①
② 同一个碳原子上连有多个羟基的结构极不稳定,不予考虑。请分析并按要求回答下列问题:
(1)写出A对应的结构简式:______________________;C→D反应类型为:_______________;
(2)写出对应反应的化学方程式:
E→G:____ _
F+K→R:
(3)有机物E的同分异构体M满足下列三个条件:
①1mol有机物与银氨溶液充分反应生成2molAg
②1mol有机物与足量NaHCO3溶液反应产生1molCO2
③1mol有机物与足量金属Na反应产生1molH2
请判断M的结构可能有_____种,任写一种M的结构简式____________。
附件1:律师事务所反盗版维 权声明
权声明

附件2:独家资源交 换签约
换签约 学校名录(放大查看)
学校名录(放大查看)
学校名录 参见
参见 :http://www./wxt/list.aspx?ClassID=3060
:http://www./wxt/list.aspx?ClassID=3060
20.(13分)
(1)白酒中乙醇含量可采用蒸馏法测定,装置如图Ⅰ所示。仪器A的名称是 ;A中温度计的位置正确的是 (填a、b、c);收集乙醇的锥形瓶须置于冰水浴中,其目的是
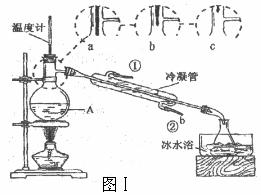
(2)为测定某白酒样品的总酸量,取20.00mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010mol/L的NaOH标准溶液滴定至终点。判断终点的依据是
;
若消耗NaOH标准溶液的体积为9.80mL,则该白酒样品中酸(用HA表示)总含量为
mol/L。
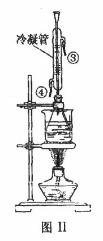
(3)白酒中的总酯量(假设全为乙酸乙酯)可用返滴定法测定:往(2)题滴定后的溶液(恰好至终点)中再加入20.00mL 0.100mol/LNaOH标准溶液,用图Ⅱ装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是 
,已知最终消耗硫酸标准溶液7.70mL,则该白酒样品中总酯量为 g/L。
(4)下列操作会使(3)题中总酯量测定结果偏高的是
a.加热时未使用水浴和冷凝管
b.选用了甲基橙为指示剂
c.滴定前滴定管内无气泡,滴定后产生气泡
d.滴定管未用硫酸标准溶液润洗
(5)图Ⅰ和图Ⅱ中均用到了冷凝管,其进水口分别为 (填字母序号)
a.①② b.②④ c.②③ d.①④
19.(9分)脱水偶联反应是一种新型的直接烷基化反应,例如:
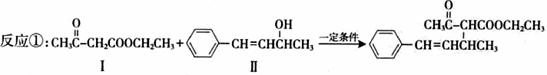
(1)化合物Ⅰ的官能团的名称为
(2)化合物Ⅱ可使____ 溶液(限写一种)褪色;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为
______ .
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有
四组峰,峰面积之比为为1:1:1:2,Ⅳ的结构简式为_______ 。
(4)由CH3COOCH2CH3可合成化合物Ⅰ.化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ。
Ⅴ的结构简式为____________,Ⅵ的结构简式为__________。
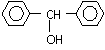

(5)一定条件下,
和
 也可以发生类似反应①的反应,
也可以发生类似反应①的反应,
反应方程式为_____ 。
二、填空题:
17.(每小题2分,共12分)下表为周期表的一部分,其中的编号代表对应的元素。
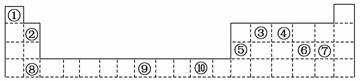
请回答下列问题:
(1)表中属于d区的元素是 ( 填编号),
填编号),
元素⑩在周期表中的位置为
(2)写出元素⑨的基态原子的外围电子排布式 。
(3)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子 的成对电子
的成对电子
为 对。
(4 )元素③与⑧形成的化合物的电子式为
,其中π键和σ键数目之比为
)元素③与⑧形成的化合物的电子式为
,其中π键和σ键数目之比为
(5)比较④的氢化物与同族第3、第4周期元素所形成的氢化物稳定性并说明理由。
[来源:]
(6)元素③⑥可形成一种常温下呈液态的化合物,请写出两种该化合物的等电子体
,
18、(每小题2分,共8分)有人设想合成具有以下结构式的烃分子
(1)结构D显然是不可能合成的,原因是___________ _________。 (2)在结构A的每两个碳原子之间插入一个CH2原子团,可以形成金刚烷的结构,写出金刚烷的分子式___ ______。 (3)B的一种同分异构体是最简单的芳香烃,能证明该芳香烃中的化学键不是单双键交替排列的事实是__________。 a.它的对位二元取代物只有一种 b.它的邻位二元取代物只有
一种 c.分子中所有碳碳键的键长均相等 d.能发生取代反应和加成反应 (4)C的一种属于芳香烃的同分异构体是生产某塑料的单体,写出合成该塑料的化学方程式为
____________ ________。
16.室温下,将120mL CH4、C2H4、C2H2混合气体跟400mL O2混合,使之充分燃烧后干燥,冷却至原来状态,体积为305mL,用NaOH溶液充分吸收CO2后,气体体积减为125mL。则原混合气体中各成分的体积比为( )
A.8∶14∶13 B.6∶1∶5 C.13∶14∶8 D.5∶1∶6
第Ⅱ卷 非选择题(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com